Maladie du sommeil
La trypanosomiase africaine, fréquemment nommée maladie du sommeil, est une forme de trypanosomiase, une maladie parasitaire génèrée par un trypanosome, qui est transmis par la piqûre de la mouche tsé-tsé ou glossine et qui affecte les humains et les animaux.

Catégories :
Infection parasitaire - Trouble du sommeil - Maladie infectieuse tropicale - Infection du système nerveux
| CIM-10 : | B56 | |
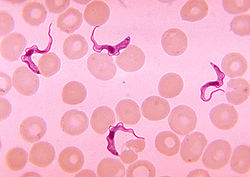
La trypanosomiase africaine, fréquemment nommée maladie du sommeil, est une forme de trypanosomiase, une maladie parasitaire génèrée par un trypanosome (protozoaire flagellé), qui est transmis par la piqûre de la mouche tsé-tsé ou glossine et qui affecte les humains et les animaux.
Deux sous-espèces d'un trypanosome (Trypanosoma brucei) génèrent chez l'humain des pathologies différentes :
- Trypanosoma brucei ssp. gambiense (Afrique de l'Ouest)
- Trypanosome brucei ssp. rhodensiense (Afrique de l'Est)
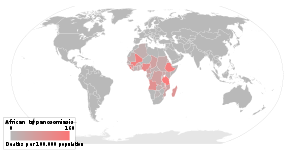
La maladie est endémique dans certaines régions de l'Afrique sub-saharienne, couvrant à peu près 36 pays et menaçant potentiellement 60 millions de personnes. On estime que 50 000 à 70 000 personnes sont aujourd'hui infectées par an, le nombre ayant diminué un peu ces dernières années.
Trois épidémies majeures se sont produites ces cent dernières années, une en 1896-1906 et les deux autres en 1920 et 1970.
La trypanosomiase du bétail est nommée Nagana («être déprimé» en Zoulou).
Caractéristiques cliniques
Les symptômes débutent par de la fièvre, des maux de tête, et des douleurs articulaires. Comme les parasites pénètrent dans l'organisme à la fois par le sang et par le dispositif lymphatique, les ganglions lymphatiques gonflent fréquemment et atteignent des tailles énormes. Le signe de Winterbottom, adénopathies cervicales postérieures (ganglions derrière le cou) peut apparaître. En l'absence de traitement, la maladie déborde progressivement les défenses de la personne infectée, et de nouveaux symptômes apparaissent, surtout l'anémie, les troubles endocriniens, cardiaques, et rénaux. La maladie entre alors dans sa phase de troubles neurologiques lorsque le parasite traverse la barrière hématœncéphalique. Les symptômes de cette deuxième phase donnent son nom à la maladie; en plus de la confusion mentale et des troubles de la coordination, le cycle du sommeil est perturbé, ce qui entraîne des accès de fatigue alternant avec des périodes d'agitation maniaque apparaissant le jour avec un assoupissement et la nuit avec l'insomnie. Sans traitement, la maladie est mortelle, avec une détérioration mentale progressive aboutissant au coma ainsi qu'à la mort. Les dommages causés dans la phase neurologique peuvent être irréversibles.
En plus de la piqûre par la mouche tsé-tsé, la maladie peut se contracter de la manière suivante :
- De la mère à l'enfant : le trypanosome peut traverser la barrière placentaire et infecter le fœtus, avec un risque de mort périnatale.
- En laboratoire : infections accidentelles, par exemple, au cours de la manipulation du sang d'une personne infectée ou par une transplantation d'organe, quoique ce soit rare.
- Sexuellement : avoir des rapports non protégés avec une personne atteinte pourrait la transmettre mais les cas avérés sont anecdotiques.
Histoire
Cette affection existe en Afrique au moins depuis le XIVe siècle, et certainement depuis des milliers d'années jusque là. L'agent causal et son vecteur n'ont été identifiés qu'en 1902-1903 par Sir David Bruce, et l'identification précise des protozoaires n'a été faite qu'en 1910. Le premier traitement efficace, l'Atoxyl, un dérivé de l'arsenic mis au point par Paul Ehrlich et Kiyoshi Shiga a été introduit en 1910 mais il présentait un risque d'effets secondaires sérieux, la cécité. De nombreuses molécules ont été présentées depuis lors pour traiter la maladie.
Il y a eu trois épidémies graves en Afrique au cours du dernier siècle : une entre 1896 et 1906, atteignant en particulier l'Ouganda et le bassin du Congo, une en 1920 dans plusieurs pays africains, et une qui a commencé en 1970 et est toujours en progression. L'épidémie de 1920 a été arrêtée par des équipes mobiles examinant toujours des millions de personnes en danger. La maladie avait quasiment disparu entre 1960 et 1965. Après ce succès, le dépistage et la surveillance s'étaient relâchés après le départ des autorités coloniales, et la maladie a réapparu sous forme endémique dans plusieurs foyers au cours des trente dernières années[1].
Distribution géographique et épidémiologique
La maladie se rencontre sous deux formes, selon le parasite en cause, Trypanosoma brucei gambiense ou Trypanosoma brucei rhodesiense . T. B. gambiense se trouve en Afrique centrale et occidentale; il provoque une atteinte chronique qui peut se prolonger sous une forme passive pendant des mois ou des années avant que les symptômes apparaissent. Le T. B. rhodesiense, est à l'origine d'une forme aiguë de la maladie mais il entraîne des effets bien plus limités. On le trouve en Afrique méridionale et orientale ; l'infection commence en quelques semaines, est plus virulente et se développe plus rapidement. Selon des estimations récentes, la maladie du sommeil est responsable d'une perte d'espérance de vie (de 9 à 10 ans) pour 2 millions de personnes[3]. Les évaluations récentes indiquent que plus de 60 millions de personnes réparties dans 250 foyers à peu près sont en danger de contracter la maladie, et il y a à peu près 300.000 nouveaux cas l'ensemble des ans[4].
La maladie a été constatée dans 36 pays, tous en Afrique sub-saharienne.
Les humains sont le réservoir principal pour Trypanosoma brucei gambiense, mais d'autres espèces peuvent aussi être retrouvées chez les porcs et d'autres animaux. Les animaux sauvages et le bétail sont le réservoir principal de T. B. rhodesiense.
Les Taons (Tabanidæ) et Stomoxydinæ peuvent certainement jouer un rôle dans la transmission passive (dans des situations spéciales) non seulement pour le Nagana (la forme animale de la maladie du sommeil) mais également de la forme humaine de la maladie[5].
Cycle parasitaire
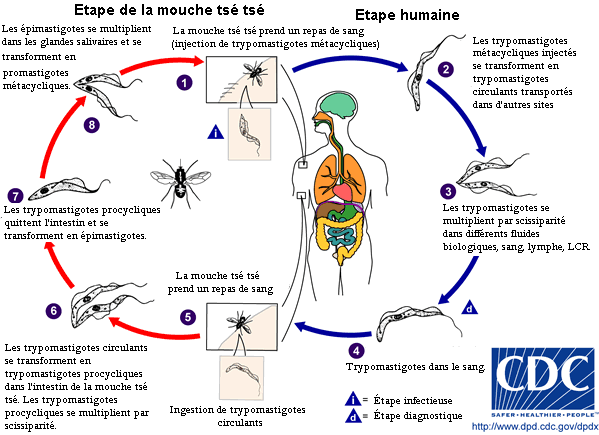
La mouche tsé-tsé est grande, brune et furtive. La piqûre est ressentie comme une aiguille chaude enfoncée dans la chair. Pendant un repas de sang sur le mammifère hôte, une mouche tsé-tsé infectée du (genre Glossina) injecte les trypomastigotes métacycliques dans le tissu cutané. Les parasites entrent dans le dispositif lymphatique et passent dans la circulation sanguine (1). Au sein de l'hôte, ils se transforment en trypomastigotes circulants dans le sang (2) et sont transportés à d'autres emplacements dans tout le corps, atteignent d'autres fluides biologiques (par exemple, lymphe, liquide céphalo-rachidien), et continuent de se répliquer par scissiparité (3). Le cycle parasitaire du Trypanosome africain est représenté par des étapes extracellulaires. Une mouche tsé-tsé s'infecte par des trypomastigotes circulants en prenant un repas de sang sur un mammifère infecté hôte (4) (5). (Dans l'intestin de la mouche, les parasites se transforment en trypomastigotes procycliques, se multiplient par scissiparité (6), quittent l'intestin, et se transforment en épimastigotes (7). Les épimastigotes atteignent les glandes salivaires de la mouche et continuent leur multiplication par scissiparité (8). Le cycle dans la mouche dure approximativement 3 semaines.
Diagnostic de laboratoire
Le diagnostic repose sur la mise en évidence des trypanosomes par l'examen au microscope du fluide d'un chancre, du liquide de ponction d'un ganglion, de sang, de mœlle osseuse, ou, aux dernières étapes de l'infection, du liquide céphalo-rachidien prélevé par ponction lombaire. Les trypanosomes mobiles sont recherchés sur une préparation humide et en outre une préparation est fixée et colorée avec la méthode de Giemsa. Des techniques de concentration peuvent être utilisées avant l'examen au microscope. Pour des échantillons de sang, on utilise la centrifugation, pour d'autres échantillons, tels que le liquide céphalo-rachidien, les techniques de concentration comprennent la centrifugation suivie de l'examen du sédiment. L'isolement du parasite par l'inoculation au rat ou à la souris est une méthode sensible, mais son utilisation est limitée au T. B. rhodesiense. La détection d'anticorps a une sensibilité et une spécificité qui sont trop variables pour en tirer des conclusions cliniques. En outre, dans les infections avec le T. B. rhodesiense, la séroconversion se produit après le début des symptômes cliniques et présente par conséquent un intérêt limité.
Trois tests sérologiques identiques sont disponibles pour la détection du parasite ; le micro-CATT, le wb-CATT, et le wb-LATEX. Le premier utilise le sang coagulé alors que les autres utilisent des échantillons de sang entier. Une étude 2002 a montré que le wb-CATT était le plus efficace pour le diagnostic, tandis que le wb-LATEX est un meilleur examen pour des situations où une plus grande sensibilité est exigée.
Traitement
Le traitement standard courant pour la première étape de la maladie est :
- La pentamidine en Intraveineuse (pour le T. b. gambiense) ;
- La suramine en Intraveineuse (pour le T. b. rhodesiense)
Le traitement standard courant pour la seconde étape de la maladie (dernière phase) est :
- Le mélarsoprol en Intraveineuse 2.2 mg/kg et par jour pendant 10 jours consécutifs[6].
La première ligne de thérapies alternative inclut :
- Le mélarsoprol en intraveineuse 0.6 mg/kg le jour 1, le mélarsoprol IV 1.2 mg/kg sur le jour 2, et 1.2/jour IV combiné avec 7.5 mg/kg par voie orale de nifurtimox deux fois par jour les jours 3 à 10[7];
ou
- L'eflornithine en Intraveineuse 50 mg/kg l'ensemble des six heures pendant 14 jours[8].
Dans les zones résistance au mélarsoprol ou chez les patients qui ont rechuté après monothérapie au mélarsoprol, le traitement devrait être :
- mélarsoprol et nifurtimox, ou
- eflornithine
Les protocoles respectant les traditions suivants ne devraient plus être employés :
- Ancien «schéma» thérapeutique de 26 jours de mélarsoprol (3 séries de 3.6 mg/kg/jour en intraveineuse pendant 3 jours, avec une interruption de sept jours entre les séries) (ce protocole est moins facile et les patients sont moins volontaires pour accomplir le traitement complet) [9];
- Traitement à doses progressives de mélarsoprol : traitement de dix jours de mélarsoprol (0.6 mg/kg IV le jour 1, 1.2 mg/kg IV le jour 2, et 1.8 mg/kg les jours 3 à 10). Ce protocole était censé diminuer le risque d'encéphalopathie induite par le traitement, mais désormais on sait qu'il est associé à un plus grand risque de rechute ainsi qu'à une incidence plus élevée de l'encéphalopathie[7], [9];
Selon une étude sur le traitement de la trypanosomiase africaine humaine à Trypanosoma gambiense, l'utilisation de l'eflornithine (DMFO) a génèré moins d'effets secondaires que le traitement avec le mélarsoprol.
Tous les patients devraient être suivis pendant deux années avec des ponctions lombaires semestrielles pour détecter les rechutes.
- Le Megazol®, molécule biologiquement active avec une activité trypanocide, a fait l'objet il y a quelque années d'études scientifiques[10]. En effet cette molécule, active sous forme de pillule (voie orale) permet d'éliminer 100% du parasite en 2 jours (tests in vitro et in vivo chez le chimpanzé et le cochon). Ce projet a surtout fait l'objet d'un partenariat entre l'OMS et AVENTIS. Des résultats contradictoires ont mis fin au projet de dévelopement d'un traitement simple à administrer (2 prises par voie orale), économique et efficace sans risque de mortalité chez le patient : le Megazol® pourrait faciliter la naissance de cancer selon l'étude effectuée chez le chimpanzé, tandis que chez le cochon (génétiquement plus proche de l'homme que le chimpanzé) il n'y a pas de risques cancéreu.
Histoire du traitement de la maladie du sommeil
La Suramine a été introduite en 1920 pour traiter la première phase de la maladie. Jusqu'en 1922, la Suramine a été le plus souvent associée à la Tryparsamide (un autre composé arsenical pentavalent) dans le traitement de la seconde phase de la forme gambiense. Il a été employé au cours de la grande épidémie d'Afrique centrale occidentale sur des millions de personnes et a été la principale thérapeutique jusqu'en 1969.
La Pentamidine, une molécule particulièrement efficace dans la première phase de la maladie, a été utilisée depuis 1939. Pendant les années 50, elle était fréquemment employée comme agent prophylactique en Afrique occidentale, conduisant à une diminution importante des taux d'infection. Dès lors, on a pensé que l'extirpation de la maladie était envisageable.
L'organoarsenical mélarsoprol (Arsobal) a été mis au point dans les années 40, et est efficace pour des patients présentant la maladie de sommeil dans sa deuxième phase. Cependant, 3 à 10 % des malades traités ont présenté une encéphalopathie (convulsions, coma progressif, ou réactions psychotiques), avec un taux de mortalité de 10 à 70 % ; elle peut provoquer des lésions cérébrales chez ceux qui survivent à l'encéphalopathie. Cependant, à cause de son efficacité, le mélarsoprol est toujours utilisé actuellement. La résistance au mélarsoprol est en augmentation, et le traitement associé avec le nifurtimox est aujourd'hui en cours d'évaluation.
La Eflornithine (difluoromethylornithine ou DFMO), le traitement le plus moderne, a été mis au point dans les années 70 par Albert Sjœrdsmanot et a fait l'objet d'essais cliniques dans les années 80. La molécule a été autorisée par les États-Unis Food and Drug Administration en 1990, mais Aventis, le laboratoire pharmaceutique responsable de sa fabrication, a cessé la production en 1999. En 2001, cependant, Aventis, en association avec Médecins Sans Frontières et l'organisation mondiale de la santé, a signé un accord à long terme pour fabriquer et distribuer le médicament. Son efficacité est démontrée, avec une tolérance meilleure que le mélarsoprol mais il existe des rechutes sous ce traitement dans légèrement moins de 10% de cas, le plus fréquemment mortelles[11].
Des traitements combinés pourraient diminuer ce risque de rechute : l'association eflornithine et nifurtimox semble, surtout, prometteuse[12].
Le génome du parasite a été décodé et plusieurs protéines ont été identifiées comme cibles potentielles pour un traitement médicamenteux. Le décodage de l'ADN a aussi permis de comprendre pourquoi la production d'un vaccin pour cette maladie a été si complexe. T brucei a plus de 800 gènes qui produisent des protéines qu'il utilise pour éviter la détection par le dispositif immunitaire. (Berriman, et autres. , 2005)
Une équipe de recherche mondiale œuvrant en République démocratique du Congo, au Soudan et en Angola impliquant Immtech mondial et l'université de la Caroline du Nord à Chapel Hill ont mené les essais cliniques en phase I et débuté un essai en phase III en 2005 pour tester l'efficacité du premier traitement par voie orale de la maladie de sommeil, réputé pour l'instant sous le nom de «DB289»[13], [14].
Des résultats récents indiquent que le parasite ne peut pas survivre dans la circulation sanguine sans son flagelle. Cette découverte donne aux chercheurs un nouvel angle d'attaque pour éliminer le parasite[15].
Des chercheurs[16] ont trouvé un mécanisme immunitaire qu'ils pensent utiliser pour créer de nouveaux traitements. Une protéine Hpr (haptoglobinrelated protein) découverte en 2006 et liée à des lipides du dispositif sanguin peut capturer l'hémoglobine et la transporter vers le corps gras auxquels elles sont liées, qui contient une toxine fatale au trypanosome. Ce mécanisme pourrait être une solution immunitaire utilisant la dépendance des trypanosomes à l'hémoglobine. Quand cette dernière a préalablement été capturée par une protéine Hpr, les trypanosomes si fixent aussi à la particule graisseuse qui empoisonne alors le parasite[17].
Prévention et contrôle
La prévention et le contrôle se focalisent, à l'endroit où c'est envisageable, sur l'extirpation de l'hôte parasite, la mouche tsé-tsé. Deux stratégies ont été employées alternativement dans les tentatives pour diminuer les trypanosomiases africaines. L'une des tactiques est essentiellement médicale ou vétérinaire et vise directement la maladie en utilisant la prophylaxie, le traitement, et la surveillance pour diminuer le nombre d'organismes porteurs de la maladie. La seconde stratégie est le plus souvent entomologique et prévoit de perturber le cycle de transmission en réduisant le nombre de mouches.
Il existe des exemples de réduction de la maladie du sommeil par l'utilisation de techniques de stérilisation des insectes.
La surveillance active régulière, impliquant la détection et le traitement des cas, en plus du contrôle des mouches de tsé-tsé, est l'épine dorsale de la stratégie pour le contrôle de la maladie du sommeil. Le dépistage systématique dans les communautés où des foyers ont été identifiés est la meilleure approche, car le dépistage au cas par cas n'est pas envisageable en pratique dans les zones de forte endémie. Le dépistage systématique peut se faire sous forme de cliniques mobiles ou de centres fixes de dépistages où les équipes voyagent quotidiennement dans les foyers. La nature de la maladie de gambiense est telle que les patients ne cherchent pas à se faire soigner assez tôt parce que les symptômes à cette phase ne sont pas évidents ou assez sérieux pour justifier une consultation médicale, à cause de l'éloignement des quelques secteurs affectés. En outre, le diagnostic de la maladie est complexe et la majorité des personnels sanitaires ne sont pas capable de la détecter. Le dépistage systématique autorise la maladie débutante d'être détectée et traitée avant que la maladie progresse, et diminue le réservoir humain potentiel[18].
Il y a eu un seul cas rapporté de transmission sexuelle de la maladie du sommeil en Afrique de l'ouest[19].
Notes et références
- ↑ (en) WHO Media centre, «Fact sheet N°259 : African trypanosomiasis or sleeping sickness», dans {{{périodique}}}, 2001
- ↑ WHO mortality and health data and statistics, accessed Feb 10, 2009.
- ↑ (en) World Health Organization (Geneva), «World Health Report 2000 : Health Systems Improving Performance», dans {{{périodique}}}, 2000 [texte intégral]
- ↑ (en) WHO Expert Committee on Control and Surveillance of African trypanosomiasis (Geneva), «WHO Technical Report Series, No. 881», dans {{{périodique}}}, 1998 [texte intégral]
- ↑ (en) T. Cherenet, R. A. Sani, J. M. Panandam, S. Nadzr, N. Speybrœck et Pé van den Bossche, «Seasonal prevalence of bovine trypanosomosis in a tsetse-infested zone and a tsetse-free zone of the Amhara Region, north-west Ethiopia», dans The Onderstepoort journal of veterinary research, vol. 71, no 4, 2004, p. 307–312 [texte intégral]
- ↑ (en) C. Burri, S. Nkunku, A. Merolle et al., «Efficacy of new, concise schedule for mélarsoprol in treatment of sleeping sickness caused by Trypanosoma brucei gambiense : a randomised trial», dans Lancet, vol. 355, no 9213, 2000, p. 1419–25 [lien PMID]
- (en) S. Bisser, F. -X. N'Siesi, V. Lejon et al., Article dans J Infect Dis, vol. 195, 2007, p. 322–29 [texte intégral].
- ↑ (en) S. van Nieuwenhove, P. J. Schechter, J. Declercq et al., «Treatment of gambiense sleeping sickness in the Sudan with oral DFMO (DL-alfa-difluoromethyl ornithine) an inhibitor of ornithine decarboxylase : first field trial», dans Trans R Soc Trop Med Hyg, vol. 79, no 5, 1985, p. 692–8.
- (en) J. Pepin et B. Mpia, «Randomized controlled trial of three regimens of melarsoprol in the treatment of Trypanosoma brucei gambiense trypanosomiasis», dans Trans R Soc Trop Med Hyg, vol. 100, 2006, p. 437–41.
- ↑ CHAUVIERE Gérard, BOUTEILLE Bernard, ENANGA Bertin, DE ALBUQUERQUE Cristina, CROFT Simon L., DUMAS Michel, PERIE Jacques Journal of medicinal chemistry 2003, vol. 46, no3, pp. 427-440
- ↑ Priotto G, Pinoges L, Fursa IB, et als. Safety and effectiveness of first line eflornithine for Trypanosoma brucei gambiense sleeping sickness in Sudan : cohort study, BMJ, 2008;336 :705-708
- ↑ Priotto G, Kasparian S, Ngouama D et als. Nifurtimox-eflornithine combination therapy for second-stage Trypanosoma brucei gambiense sleeping sickness : a randomized clinical trial in Congo, Clin Infect Dis, 2007;45 :1435-42
- ↑ Williamson : Compound might defeat African sleeping sickness, clinical trial beginning this month, University of North Carolina (August 25, 2005).
- ↑ Staff : Clinical Trials Update, Genetic Engineering News (September 15, 2005), p. 5.
- ↑ African Sleeping Sickness Breakthrough. Consulté le 07 avril 2006
- ↑ équipe de l'Université d'Aarhus et de l'Université Libre de Bruxelles, étude parue dans la revue Science en mi-2008
- ↑ Vanhollebeke B, et al. A haptoglobin-hemoglobin receptor conveys innate immunity to Trypanosoma brucei in humans, Science (résumé
- ↑ Strategic Direction for African Trypanosomiasis Research, Special Programme for Research and Training in Tropical Diseases. Consulté le 1er mars 2006
- ↑ (en) G. Rocha, A. Martins, G. Gama, F. Brandão et J. Atouguia, «Possible cases of sexual and congenital transmission of sleeping sickness», dans Lancet, vol. 363, {{{année}}}, p. 247 [lien PMID]
Bibliographie
- (en) M. Berriman et al., «The genome of the African trypanosome Trypanosoma brucei», dans Science, vol. 309, no 5733, 2005, p. 416–22 [texte intégral lien PMID]
- (en) M. P. Barrett et al., «The trypanosomiases», dans Lancet, vol. 362, no 9394, 1er novembre 2003, p. 1469-80 [texte intégral lien PMID]
Voir aussi
Liens et documents externes
- Doctors Without Borders/Medecins Sans Frontieres Sleeping sickness information page
- Medecins Sans Frontieres'Eflornithine press release, 2001
- Links to pictures of Sleeping Sickness (Hardin MD/Univ of Iowa)
- The Sandler Center for Basic Research in Parasitic Diseases, University of California, San Francisco.
- Kids For World Health
Recherche sur Google Images : |
|
"la maladie du sommeil de" L'image ci-contre est extraite du site ird.fr Il est possible que cette image soit réduite par rapport à l'originale. Elle est peut-être protégée par des droits d'auteur. Voir l'image en taille réelle (403 x 600 - 273 ko - )Refaire la recherche sur Google Images |
Recherche sur Amazone (livres) : |
Voir la liste des contributeurs.
La version présentée ici à été extraite depuis cette source le 22/11/2009.
Ce texte est disponible sous les termes de la licence de documentation libre GNU (GFDL).
La liste des définitions proposées en tête de page est une sélection parmi les résultats obtenus à l'aide de la commande "define:" de Google.
Cette page fait partie du projet Wikibis.

 Accueil
Accueil Recherche
Recherche Début page
Début page Contact
Contact Imprimer
Imprimer Accessibilité
Accessibilité