Paludisme / Fièvre bilieuse hémoglobinurique
Le paludisme, nommé aussi malaria, est une parasitose due à un protozoaire transmis par la piqûre de la femelle d'un moustique, l'anophèle, provoquant des fièvres intermittentes.

Catégories :
Paludisme - Maladie tropicale - Maladie infectieuse en hématologie - Parasitologie médicale - Zoonose
Recherche sur Google Images :
Source image : fr.wikipedia.org Cette image est un résultat de recherche de Google Image. Elle est peut-être réduite par rapport à l'originale et/ou protégée par des droits d'auteur. |
Définitions :
- Le paludisme est une maladie parasitaire potentiellement mortelle transmise par des moustiques. Le parasite, nommé plasmodie, pénètre chez son... (source : who)
| Classifications CIM du Paludisme Classification et ressources externes |
|
| CIM-10 | B50 à B54 |
|---|---|
| CIM-9 | 084 (84.0 à 84.9) |

Le paludisme (du latin paludis, marais[1]), nommé aussi malaria (de l'italien mal'aria, mauvais air[2]), est une parasitose due à un protozoaire transmis par la piqûre de la femelle d'un moustique, l'anophèle, provoquant des fièvres intermittentes. Avec 300 à 500 millions de malades et 1, 5 à 2, 7 millions de décès par an, le paludisme demeure la parasitose tropicale principale. 80 % des cas sont enregistrés en Afrique subsaharienne, où ils concernent surtout les enfants de moins de cinq ans et les femmes enceintes (OMS, 2005) (voir les régions à risques).
La cause de la maladie a été découverte le 6 novembre 1880 à l'hôpital militaire de Constantine (Algérie) par un médecin de l'armée française, Alphonse Laveran, qui reçut le prix Nobel de médecine et de physiologie en 1907. C'est en 1897 que le médecin anglais Ronald Ross (prix Nobel 1902) prouva que les moustiques (Anopheles) étaient les vecteurs de la malaria (jusqu'à cette date, le mauvais air émanant des marécages était tenu responsable de la propagation de la maladie).
Les parasites Plasmodium (en particulier P. falciparum – anciennement dénommé præcox –, P. vivax, plus rarement P. ovale et P. malariæ) sont transmis par la piqûre de la femelle d'un moustique nommé anophèle (genre Anopheles). Le parasite sévit à l'état endémique, infecte les cellules hépatiques de la victime puis circule dans le sang, en colonisant les hématies (globules rouges) et en les détruisant.
Histoire
Depuis les origines de l'Homme

Le paludisme affecte les êtres humains depuis plus de 50 000 ans et aurait été un pathogène depuis le début de l'histoire de notre espèce[3]. On trouve ainsi des parasites proches de celui de la malaria chez les chimpanzés, l'espèce la plus proche de l'Humain[4]. Il y a à peu près 10 000 ans, le paludisme commence à avoir un impact majeur sur la survie humaine, ce qui coïncide avec le début de l'agriculture (révolution néolithique) par conséquent à la sédentarisation. Une des conséquences (impact + modification du mode de vie) en est la sélection naturelle des gènes de la drépanocytose, des thalassémies, du déficit en glucose-6-phosphate déshydrogénase, de l'elliptocytose héréditaire (appelée occasionnellementovalocytose). Ces maladies qui touchent les globules rouges du sang, donnent un avantage sélectif envers le paludisme (Voir le sous titre concernant les facteurs génétiques).
Des fièvres mortelles - dont certainement le paludisme - ont été rapportées depuis les premiers rédigés. On trouve ainsi des références à des périodes de fièvre paludique dès 2 700 avant J. -C. en Chine[5]. En Inde, dès l'antiquité, les Veda (Textes de la connaissance) font état des fièvres paludiques et les médecins Charaka et Sushruta (certainement Ve siècle av. J. -C. ) en font une description et lui associent, déjà, la piqûre de moustique. Les symptômes de fièvre intermittente ont été décrits par Hippocrate. Il lie ces fièvres à certaines conditions climatiques et environnementales, et divise les fièvres en trois types : febris tertiana (tous les deux jours), quartana (tous les trois jours), et quotidiana ou continua (maintenant nommée tropica). Vers 186 avant J. -C. apparaît, dans certaines régions de Chine, l'utilisation, en tisane, du qing hao su (???) nommé plus tard artémisinine en Occident et extrait d'une plante médicinale utilisée comme antipyrétique nommée qing hao (??) (Artemisia annua ou «Armoise annuelle»).
Le paludisme était commun dans des lieux du monde où il est inconnu désormais, comme en Europe et en Amérique du Nord. Dans certains lieux d'Angleterre, la mortalité due à la malaria était comparable à celle de l'Afrique sub-saharienne d'aujourd'hui. Même si William Shakespeare est né au début d'une période plus froide nommée le «petit âge glaciaire», il connaissait suffisamment les ravages de cette maladie pour les citer dans huit de ses pièces. En France métropolitaine, la malaria n'a disparu que assez il y a peu de temps. Elle était toujours présente en 1931, dans le marais poitevin, le golfe du Morbihan et en Camargue. Elle a été éradiquée de Corse, où on la trouvait dans la plaine orientale, en 1944. Les troupes américaines la firent disparaître en traitant massivement la zone au DDT. Inconnu du temps de la présence romaine, le paludisme fut introduit lors des raids vandales. L'île connaîtra ses deux dernières épidémies non importées à Plasmodium vivax en 1970 (31 cas) et 1971 (19 cas). Depuis, l'ensemble des cas observés en France (1 025 cas en 1986) sont des paludismes d'importation. Plasmodium vivax a sévit jusqu'en 1958 dans les zones de Polder de Belgique et des Pays-Bas.
Dans les années 1500, ce sont les colons européens et leurs esclaves qui ont certainement amené le paludisme sur le continent américain (on sait que Christophe Colomb était atteint de cette maladie avant son arrivée dans les terres nouvelles). Les jésuites missionnaires espagnols virent que les Indiens riverains du lac de Loxa au Pérou utilisaient de la poudre d'écorce de Cinchona pour soigner les fièvres. Cependant, on ne trouve aucune référence au paludisme dans les ouvrages médicaux des Maya ou des Aztèques. L'utilisation de l'écorce de «l'arbre à fièvre» a été introduite dans la médecine européenne par les missionnaires jésuites dont Barbabe de Cobo qui l'expérimente en 1632 et l'exporte aussi si bien que la précieuse poudre s'appela aussi «poudre des jésuites»[6].
Les facteurs critiques affectant la propagation ou l'éradication de la maladie ont été les comportements humains (déplacements de population, méthodes d'agriculture, etc. ), le niveau de vie (la pauvreté était et reste la principale cause de mortalité) et la densité de la population (plus la densité humaine est grande et plus la densité de moustiques sera grande).
XVIIIe et XIXe siècles : premières études scientifiques
En 1717, la pigmentation post-mortem au graphite de la rate et du cerveau est publiée par Giovanni Maria Lancisi, le médecin du pape Clément XI, dans un ouvrage, édité en 1717, sur le paludisme De noxiis paludum effluviis eorumque remediis. Il y présente des preuves que la maladie est transmise par les mouches. Lancisi introduit le mot mal'aria, «mauvais air».
En 1820, Pierre Joseph Pelletier et Joseph Bienaimé Caventou séparent les alcaloïdes cinchonine et quinine de la poudre de l'écorce de «l'arbre à fièvre», donnant la possibilité la création de doses standardisées des composants actifs[7].
En 1848, Johann Friedrich Meckel von Helmsbach (surnommé Meckel "le jeune") note la plupart de granules noir-bruns dans le sang et la rate d'un patient qui venait de mourir dans un hôpital psychiatrique. Meckel "le jeune" était certainement en train de voir des parasites de malaria sans le comprendre, car il ne mentionne pas le paludisme dans son rapport, en pensant que le pigment était de la mélanine.
En 1856, lors des essais, sans succès, pour synthétiser la quinine de façon commercialement viable, William Henry Perkin produit de la mauvéine par l'oxydation de l'o-toluidine. Avant cette découverte, les colorants et les peintures étaient issus de racines, de feuilles, d'insectes ou, dans le cas du pourpre, de mollusques. La découverte de Perkin des colorants artificiels permit de grandes avancées dans le domaine de médecine, de la photographie et d'autres domaines.
En 1865, Charles Ledger et un indien appelé Manuel font littéralement le trafic des graines de quinquina (Cinchona calisaya aussi nommé Cinchona Ledgeriana) en provenance de l'Équateur, du Pérou et de Bolivie. Des plantations sont alors établies sur l'île de Java par les Hollandais, après avoir acquis des graines aux Anglais, qui établissent, ainsi, un monopole mondial sur la quinine. La même année, Carlos Finlay, un médecin cubain qui traite les patients atteints de la fièvre jaune à La Havane, suggère que ce sont les moustiques qui transmettent cette maladie aux humains.

En 1880, Charles Louis Alphonse Laveran établit, en Algérie, la relation entre les observations faites par Meckel "le jeune" (en 1848) et le parasite qu'il observe pour la première fois dans les globules rouges de 44 personnes souffrant du paludisme. En voyant l'exflagellation se produire, il devient convaincu que les flagelles mobiles sont des micro-organismes parasites (minuscules êtres vivants unicellulaires qui se multiplient végétativement par mitose). Or bien des médecins de l'époque pensaient toujours que les protozoaires n'étaient en fait que des globules rouges altérés. Laveran devra se battre pour faire admettre sa théorie car restait à trouver comment ces organismes s'introduisaient dans le corps humain. N'ayant pas obtenu un poste lui servant à poursuivre ses recherches, Laveran prend sa retraite et poursuit ses recherches sur les protozoaires à l'Institut Pasteur comme bénévole. C'est en 1898 qu'il va publier son Traité du paludisme. Il voit aussi l'effet de la quinine, qui détruit ces parasites. Il suggère que le paludisme est causé par ce protozoaire. C'est la première fois qu'un protozoaire est identifié comme étant la cause d'une maladie[8]. Cette découverte lui vaut l'attribution du prix Nobel de médecine en 1907. Les études scientifiques sur le paludisme viennent de faire leur première avancée significative.
En 1884 le Dr Patrick Manson émet le premier l'hypothèse qu'il doit s'agir d'un moustique qui absorbe le parasite et pond dans l'eau que l'homme ingurgite. L'année suivante, Ettore Marchiafava, Angelo Celli et Camillo Golgi étudient le cycle de reproduction du sang humain (cycle de Golgi) et observent que l'ensemble des parasites présents dans le sang se divisent environ simultanément à intervalles réguliers et que la division coïncide avec les attaques de fièvre. Golgi montre qu'il existe plusieurs types de paludisme causés par des organismes protozoaires différents. Le protozoaire est nommé Plasmodium par les scientifiques italiens Ettore Marchiafava et Amico Bignami[9].
En 1891, Guttmann et Paul Ehrlich remarquent que le bleu de méthylène a une grande affinité pour certaines cellules et que ce colorant a de faibles propriétés antipaludéennes. Ehrlich veut promouvoir le développement de médicaments en exploitant les différences biochimiques.
En 1895, l'expédition française de Madagascar fut un «désastre sanitaire» : sur 21 600 hommes débarqués, 5 731 sont morts du paludisme et 25 sont morts au combat[10]. À noter que ce genre de «désastre» se reproduira fréquemment comme au cours de la guerre du Vietnam pour les soldats Nord-vietnamiens (voir l'article sur l'artémisinine).

En 1898, c'est le Britannique Ronald Ross, œuvrant en Inde et correspondant régulièrement avec Laveran et Manson mais qui a du mal à imaginer pourquoi l'insecte ne transmet pas directement le parasite par piqûre, qui prouvera finalement que le paludisme est transmis par cette piqûre. Pour confirmer sa théorie, il dissèquera pendant deux ans des oiseaux paludéens qu'il faisait piquer par des centaines de variétés de moustiques et ce n'est qu'après ces deux ans, au bord du découragement, qu'il remarque une espèce de moustique qui ne se développe que dans les eaux de surface et ne se voit que la nuit : l'anophèle. Il continue alors ses recherches, il récolte et élève les larves et retrouve des protozoaires de Laveran vers le septième jour dans l'estomac de l'anophèle. La preuve est établie, c'est bien cet insecte qui transmet le parasite vivant à ses dépens. Il constate qu'une période d'incubation de 10 à 14 jours est indispensable entre la piqûre et la naissance des parasites dans le sang. Il venait de prouver que certaines espèces de moustiques transmettent le paludisme aux oiseaux, en isolant les parasites des glandes salivaires des moustiques qui se nourrissent des oiseaux affectés[11]. Ceci lui vaut le prix Nobel de médecine en 1902. Après avoir démissionné des services médicaux indiens, Ross travaille pour l'école de médecine tropicale de Liverpool alors récemment créée, et dirige les efforts d'éradication du paludisme en Égypte, au Panama, en Grèce et sur l'île Maurice[12].
En 1899, le zoologiste italien Giovanni Battista Grassi, se basant sur les travaux de Ross (sur les oiseaux), fit de même pour le vecteur chez les humains et prouva que le cycle vital du Plasmodium a besoin du moustique comme étape indispensable.
L'année suivante, les découvertes de Finlay et Ross sont confirmées par une équipe médicale dirigée par Walter Reed et les recommandations sont mises en place par William C. Gorgas lors de la construction du canal de Panama. Les mesures de santé publique ainsi adoptées ont sauvé les vies de milliers d'ouvriers (tandis que plusieurs milliers d'autres y étaient morts jusque là) et ont aidé à développer les futures méthodes de lutte contre la maladie.
XXe et XXIe siècles : à la recherche de traitements
Au début du XXe siècle, avant les antibiotiques, les patients atteints de syphilis étaient volontairement «traités» en les infectant avec le paludisme, pour leur donner de la fièvre. Dans les années 1920, Julius Wagner-Jauregg commence à traiter les neurosyphilitiques avec le paludisme induit par P. vivax. Trois ou quatre accès de fièvre se révèlent assez pour tuer les bactéries de syphilis, alors que l'infection de paludisme est arrêtée avec la quinine. En contrôlant exactement la fièvre avec la quinine, les effets des deux maladies peuvent alors être maitrisés. Quoique certains patients soient morts de la malaria, le traitement valait mieux qu'une mort certaine de la syphilis[13]. Le traitement thérapeutique par le paludisme ouvrit la voie aux recherches en chimiothérapie et resta pratiqué jusque vers 1950.
En 1922, Stephens, identifia le 4e parasite connu du paludisme chez l'homme, P. ovale.
Dans les années 1930, aux laboratoires Elberfield de IG Farben en Allemagne, Hans Andersag et ses collègues synthétisent et testent à peu près 12 000 composants différents et arrivent à produire la Resochine®[14], un substitut de la quinine. Elle est liée à la quinine car elle possède un noyau de quinoline. Cette Resochine® (RESOrcinate d'un 4-aminoCHINoline : 7-chloro-4-[[4- (diethylamino) - 1 - methylbutyl] amino] quinoline) et un composant identique, la Sontonchine (3-methyl Resochine) sont synthétisés en 1934 en coopération avec des entreprises américaines, grâce à plus de 2 000 accords entre IG Farben et des compagnies étrangères, comme Standard Oil of New Jersey, DuPont, Alcoa, Dow Chemical, Agfa, Winthrop Chemical Company et d'autres compagnies américaines [15]. Ce médicament est plus tard nommé Chloroquine. La Chloroquine (Resochine) est un inhibiteur de la biocristallisation des pigments et un des meilleurs antimicrobiens jamais créé[16]. La quinine comme la chloroquine affectent les parasites de la malaria au début de leur cycle de vie, lorsque les parasites forment des pigments d'hématine, dérivant de la dégradation de l'hémoglobine.
Les propriétés insecticides du DDT (dichloro diphényl trichloro-éthane) sont établies, en 1939 par Paul Hermann Müller œuvrant à Geigy Pharmaceutical à Bâle en Suisse grâce au Pyrethrum fait de Pyrèthre de Dalmatie (plante de la famille des chrysanthèmes) écrasée, l'épandage de DDT est une méthode standard de protection contre les insectes. Cependant, à cause de l'impact environnemental du DDT et de la résistance développée par les moustiques, le DDT est de moins en moins utilisé, en particulier dans les zones où le paludisme n'est pas endémique (Voir aussi le sous titre «Les moyens de combattre le moustique»).
En 1949, J. B. S. Haldane suggère que les thalassémiques hétérozygotes seraient plus résistants au paludisme. En novembre, Linus Pauling, Harvey Itano, S. J. Singer et Ibert Wells publient dans le journal Science la première preuve d'une maladie humaine causée par une protéine anormale[17]. En utilisant l'électrophorèse, ils démontrent que les individus atteints de drépanocytose ont une hémoglobine modifiée, et que les hétérozygotes, qui ont à la fois des formes normales et anormales d'hémoglobine, sont plus résistants aux infections de paludisme. C'est aussi mais aussi on démontre que les lois de Mendel déterminent les propriétés physiques des protéines, et non pas uniquement leur absence ou présence : c'est le début de la génétique moléculaire.
Au cours de la guerre du Vietnam, en réponse à une demande expresse des «Việt Cộng», une étude systématique de plus de 200 plantes médicinales chinoises est entreprise sous la direction de la pharmatologue Youyou Tu et de son groupe de recherche à Pékin en 1972. Le qing hao su (???), nommé artémisinine en Occident, est extrait à faible température dans un milieu neutre (pH 7) de plantes de qing hao (??) séchées, selon les instructions de Ge Hong. Ce dernier était le premier, au IVe siècle à recommander l'utilisation de qing hao pour le traitement de «fièvres intermittentes» dans son ouvrage Handbook of Prescriptions for Emergencies. Il recommande de faire tremper les feuilles et les branches de l'armoise pendant une nuit, d'extraire le jus amer et de le boire directement.
Les premières cultures du parasite à leur phase sanguine sont réalisées en 1976 par Trager et Jensen, dans des jarres à bougies, ce qui favorise énormément le développement de nouveaux médicaments[18].
Bien que les différentes étapes sanguines et le vecteur du paludisme (l'anophèle) aient été identifiés dès le XIXe siècle, ce n'est qu'en 1980 que la forme latente (cycles exo-érythrocytaires secondaires qui vont entretenir dans le foie la parasitose pendant 3 à 5 ans ou plus pour P. Vivax, 2 ou 3 pour P. Ovale et au cours de la vie entière pour P. Malariæ) du parasite dans le foie est observée[19]. La découverte de cette forme latente du parasite explique enfin pourquoi des individus apparaissent guéris du paludisme mais rechutent plusieurs années après que le parasite eut disparu de leur sang (Voir aussi le sous titre «Phase hépatique»).
Le présent
Article détaillé : Traitements actuels
Le futur
La pharmacologie
En 2004, des chercheurs, sous la direction du Docteur Jonathan Vennerstrom, de l'Université du Nebraska aux États-Unis ont réussi a synthétiser de l'acide artémisinique pouvant être converti en artémisinine plus efficace (en tests in vitro) que celle produite naturellement. Cette molécule a été appelée OZ-277 (aussi connue sous le nom de RBx11160). Aucune résistance de la part de Plasmodium ne serait aujourd'hui connue.
En mars 2006, des chercheurs du Centre d'études et de recherche des médecins d'Afrique en collaboration avec le centre hospitalier universitaire et le Laboratoire de Chimie de la Coordination (CNRS) de Toulouse ont montré l'efficacité de diverses plantes dont le Quassia. À la même date, des chercheurs de l'université de Lille I ont annoncé avoir développé une nouvelle molécule, la «ferroquine», en greffant à un lieu précis, dans la molécule de chloroquine un ferrocène. Cette nouvelle molécule serait jusqu'à 30 fois plus efficace que la chloroquine. On ne connait, pour le moment, aucun cas de résistance chez P. falciparum (aussi bien sur des isolats de terrain que sur des lignées de parasites entretenues en laboratoire).
En septembre 2006, une équipe associant l'université Paul-Sabatier de Toulouse, le CNRS, l'IRD, et le Muséum national d'Histoire naturelle, annonce avoir isolé un des principes actif antipaludique de la tisane de Quassia utilisée par des populations locales de Guyane contre le paludisme. (Journal of Ethnopharmacology).
En 2008, des biologistes du Georgia Institute of Technology d'Atlanta ont révélé que certains composés fongicides naturels de l'algue rouge Serratus Callophycus inhibent l'action du Plasmodium quoique le lien entre activité antifongique et antipaludique n'est pas encore compris[20].
Les vaccins
Le premier vaccin antipaludéen, le SPf66[21], un vaccin synthétique, fut découvert en janvier 1986 par Manuel Elkin Patarroyo. Son efficacité était cependant assez faible voir nulle pour P. falciparum.
Actuellement trois types de recherche de deuxième génération sont basées sur les divers antigènes issus des différents stades du cycle évolutif parasitaire :
- vaccins anti-stade exo-érythrocytaire : ils visent à empêcher le sporozoïte de pénétrer ou de se développer dans les cellules hépatiques;
- vaccins anti-stade sanguin asexué (antimérozoïte) : ils empêchent les mérozoïtes de pénétrer ou de se développer dans les hématies;
- vaccins bloquant la transmission : ils induisent des anticorps empêchant la maturation des stades sexués du parasite chez l'anophèle.
Depuis 1992, un vaccin antimérozoïte prometteur nommé RTS, S/AS02A[22] est en développement chez GlaxoSmithKline Biologicals à Rixensart en Belgique. En décembre 2005, le professeur Alonso de l'université de Barcelone publie des résultats encourageants car il s'avèrerait efficace, dès la 1re injection, dans 30 % des cas et éviterait la moitié des crises graves[23]. Depuis le 26 mai 2009, il est au stade de la phase III des essais cliniques et les tests montrent que son efficacité sera supérieure aux espoirs[24]. Il est préparé à partir de peptides parasitaires de synthèse et de protéines recombinantes (capable d'échanger des informations génétiques avec une autre protéine) ou d'ADN (découvert dans les mitochondries et les apicoplastes de Plasmodium). Sachant que le parasite, pour pénétrer les hématies, prend la forme d'une protéine et est capable de muter une soixantaine de fois pour tromper le dispositif immunitaire, cette piste utilise deux protéines recombinantes qu'elle fusionne :
- une partie de la protéine circumsporozoïtaire (CSP = Circum Sporozoïte Protein) de P. falciparum (RTS) ;
- l'antigène de surface du virus de l'hépatite B (S) ;
- un adjuvant qui se compose de 250 µl d'émulsion d'huile dans l'eau, de 50 µg de saponine QS21 et de 50 µg de (MPL™) lipide monophosphoryque immunostimulant A (AS02A).
C'est le vaccin de deuxième génération le plus avancé. Si l'ensemble des études et les tests continuent à se dérouler normalement, il pourra être commercialisé entre 2010 et 2011 et entrer en phase IV des essais cliniques.
Nombre d'autres chercheurs se penchent aussi sur une solution par vaccin :
- Depuis 2002, la Faculté de biologie et de médecine (FBM) de l'Université de Lausanne en Suisse étudie un vaccin antimérozoïte nommé PfCS102/AS02A[25] basé sur une peptide de synthèse circumsporozoïtaire (PfCS = Peptide Circum Sporozoïte Protein) de P. falciparum (PfCS102) renforcée par un adjuvant. Au départ, ce fut le Montanide ISA 720 remplacé depuis par l'AS02A de GSK Bio car donnant une meilleure réponse du dispositif immunitaire. Les résultats obtenus sont identiques au RTS, S/AS02A. Il est , depuis 2005, dans le stade de la phase II des essais cliniques.
- En novembre 2005, l'Institut Pasteur annonçait le début de la phase I des essais cliniques sur l'être humain d'un prototype de vaccin antimérozoïte basé sur les antigènes et nommé MSP3[26]. Pour le concevoir, les chercheurs ont étudié les mécanismes des personnes naturellement immunisées.
- En 2006, le Département de la Défense des États-Unis (DoD) demande à l'Institut de Médecine (IOM) de l'Académie nationale des Sciences (NAS) de reprendre le programme de recherche qu'il avait, lui-même, débuté en 1986 et devant aboutir au développement d'un vaccin protégeant les militaires contre P. falciparum[27].
La génétique
En 2000, l'équipe du Professeur Andrea Crisanti[28] de l'Imperial College London parvient a créer le premier moustique génétiquement modifié. Malheureusement, en 2003, elle est en devoir d'annoncer que si le gène marqueur persiste pendant une trentaine de génération lors de la fécondation entre moustiques modifiés, ce dernier ne subsiste que pendant 4 à 16 générations lors d'une fécondation avec un moustique non modifié[29].
Épidémiologie
Répartition dans le monde
Chaque année, le paludisme est la cause de 400 à 900 millions de cas de fièvres, et entre un et trois millions de morts[30], soit en moyenne un mort l'ensemble des 30 secondes[31]. La grande majorité des victimes sont des enfants de moins de 5 ans[32], les femmes enceintes étant aussi spécifiquement vulnérables car le placenta forme une cible où les parasites (Plasmodium falciparum) peuvent s'accumuler. Malgré les efforts entrepris pour diminuer la transmission de la maladie et perfectionner son traitement, il y a eu peu d'évolution depuis le début des années 1990[33]. Il y a plus grave : si la prévalence du paludisme continue à son rythme actuel, le taux de mortalité pourrait doubler dans les vingt prochaines années[30]. Les statistiques précises sont complexes à obtenir, à cause de la prévalence de la maladie dans les zones rurales, où les gens n'ont pas accès à un hôpital ou les moyens de se soigner. La majorité des cas ne sont pas documentés[30].
La co-infection avec le VIH n'accroît pas la mortalité, et pose moins de problème que la co-infection paludisme / tuberculose, les deux maladies s'attaquant généralement à des tranches d'âge différentes : le paludisme est plus habituel chez les jeunes alors que la tuberculose atteint davantage les personnes âgées[34]. Cependant, la paludisme et le VIH contribuent à leur propagation mutuelle : le paludisme accroît la charge virale et l'infection du VIH augmente la probabilité d'une infection de paludisme[35].
Le paludisme est endémique dans les zones intertropicales dans les Amériques, dans de nombreux lieux d'Asie, et dans la majorité de l'Afrique. C'est cependant dans l'Afrique sub-saharienne qu'on trouve 85 à 90 % des morts du paludisme[36]. La distribution géographique de la maladie au sein de grandes régions est complexe, et on trouve ainsi des zones paludiques et non-paludiques proches l'une de l'autre[37]. Dans les régions sèches, les périodes de paludisme peuvent être prédîtes sans trop d'erreurs en utilisant les cartes de précipitation[38]. À l'oppose de la dengue, le paludisme est davantage présent dans les campagnes que dans les villes[39]. A titre d'exemple, les villes du Viêt Nam, du Laos et du Cambodge sont quasiment exemptes de paludisme, mais ce dernier reste présent dans les campagnes[40]. En Afrique par contre, le paludisme est présent autant dans les zones rurales qu'urbaines, même si le risque est diminué dans les grandes villes[41]. Les niveaux endémiques mondiaux de la maladie n'ont pas été cartographiés depuis les années 1960. Cependant, le Wellcome Trust britannique finance le Malaria Atlas Project[42] pour rectifier ceci et d'évaluer le poids de cette maladie à l'avenir.
Au final, le paludisme est la maladie parasitaire la plus commune dans le monde. Elle est au 1er rang des priorités de l'OMS tant par ses ravages directs que par ses conséquences socio-économiques dont : une improductivité aboutissant à la sous-alimentation et au sous-développement.
L'être humain est loin d'être l'unique hôte à subir le paludisme. A titre d'exemple, nombreux sont les oiseaux qui sont porteurs de ces parasites, surtout de Plasmodium relictum.
Régions à risques
Après avoir sévi dans la presque totalité du monde habité, le paludisme touche 90 pays[43], principalement les plus pauvres d'Afrique, d'Asie et d'Amérique latine. Dans les années 1950, le paludisme avait été éradiqué de l'essentiel de l'Europe et d'une grande partie de l'Amérique centrale et du sud par des pulvérisations de DDT et l'assèchement des marais.
En 2006, l'Europe a connu de très nombreux cas de paludisme d'importation essentiellement en France (5.267 cas), au Royaume-Uni (1.758 cas) et en Allemagne (566 cas) [44]. En France 558 cas sont des militaires, mais la maladie touche aussi les touristes : sur cent mille d'entre eux se rendant dans une zone impaludée, trois mille rentrent dans leur pays infectés par l'une des formes connues de Plasmodium, le reste sont des cas importés par des immigrants.
- L'Afrique est un continent spécifiquement touché par le paludisme ; il concerne 95 % des cas importés en France. Le danger est quasi-nul en Afrique du Nord mais majeur en Afrique de l'Est, en Afrique subsaharienne et en Afrique équatoriale autant en zone rurale qu'en zone urbaine.
- En Asie, le paludisme est absent des grandes villes et plutôt rare dans les plaines côtières. Le danger est majeur dans les zones rurales du Cambodge, de l'Indonésie, du Laos, de la Malaisie, des Philippines, de la Thaïlande, du Viêtnam et en Chine dans le Yunnan ainsi qu'à Hainan.
- Dans les Antilles, le paludisme sévit à Haïti et près de la frontière dominicaine.
- En Amérique centrale, il existe quelques micro-zones, mais le risque est assez faible.
- En Amérique du Sud, le risque est faible dans les grandes villes, mais réel dans les zones rurales en Bolivie, en Colombie, en Équateur, au Pérou et au Venezuela, et majeur dans toute la zone amazonienne.
L'altitude et la température ambiante sont des facteurs importants dans l'impaludation ou non dans une zone.
- Certains anophèles (comme Anopheles gambiæ) ne peuvent vivre guère au-delà de 1.000 m d'altitude mais d'autres (comme Anopheles funestus) sont idéalement adaptés pour vivre jusqu'à 2.000 m[45]
- La maturation de Plasmodium au sein de l'anophèle ne peut s'opérer que dans une fourchette de température ambiante allant de 16 à 35 C°
Impact socio-économique
Le paludisme est couramment associé à la pauvreté, mais il représente aussi une cause majeure de la pauvreté et un frein important au développement économique et humain. La maladie a des effets économiques négatifs dans les régions où elle est répandue. Une comparaison du PIB par habitant en 1995, ajustée par parité à pouvoir d'achat, entre les pays touchés par le paludisme et ceux non touchés, montrait des écarts de 1 à 5 (1 526 USD contre 8 268 USD). De plus, dans les pays où le paludisme est endémique, le PIB pays habitant a cru de 0, 4 % par an en moyenne de 1965 à 1990, contre 2, 4 % pour les autres pays[46]. Cette corrélation ne montre cependant pas que la causalité, et la prévalence du paludisme dans ces pays est aussi en partie dû aux capacités économiques réduites pour combattre la maladie.
Le coût économique global du paludisme est estimé à 12 milliards de USD par an pour l'Afrique seule. Un cas exemplaire est celui de la Zambie. Si le budget que le pays consacrait pour lutter contre cette maladie en 1985 était de 25 000 USD. Depuis 2008, grâce à l'aide mondiale et au PATH (Program for Appropriate Technology in Health), il est de 33 millions répartis sur une période de 9 ans avec, comme 1er objectif la fourniture, à toute la population, de moustiquaires [47].
Au niveau individuel, l'impact économique inclut les frais de soins et d'hospitalisation, les jours de travail perdus, les jours de présence à l'école perdus, la baisse de productivité due aux dommages cérébraux créés par la maladie ; pour les états, à ces impacts s'ajoutent des baisses d'investissement et du tourisme[32]. Dans certains pays spécifiquement touchés par le paludisme, la maladie peut être responsable de 40 % des dépenses publiques de santé, 30 à 50 % des patients admis à l'hôpital, et jusqu'à 50 % des consultations[48].
Causes
Le paludisme est causé par des parasites de l'espèce Plasmodium, eux-mêmes transmis par les moustiques du genre Anopheles.
Le Plasmodium, parasite du paludisme
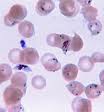
Le paludisme est causé par un parasite protozoaire du genre Plasmodium (Phylum apicomplexa). Chez les humains, le paludisme est , principalement, causé par P. falciparum (prépondérant en régions tropicales), P. malariæ, P. ovale (espèce la plus rare, outre l'Afrique de l'Ouest ) et P. vivax (espèce la moins stricte en température).
P. falciparum est la cause la plus commune des infections et responsable d'environ 80 % de l'ensemble des cas de paludisme mais aussi 90 % des décès[49]. Les Plasmodium infectent aussi les oiseaux, les reptiles, les singes, les chimpanzés et les rongeurs (animaux à sang chaud) [50]. On a rapporté des cas d'infections humaines avec des espèces simiesques du paludisme, dont P. knowlesi , P. inui , P. cynomolgi [51], P. simiovale , P. brazilianum , P. schwetzi et P. simium . Cependant, à l'exception de P. knowlesi, ces infections restent limitées et sans importance en termes de santé publique. Le paludisme aviaire peut tuer les poulets et les dindes, mais cette maladie ne cause pas de dommages économiques notables à l'agriculture[52]. Cependant, depuis qu'il a été introduit par les humains, le paludisme a décimé les espèces endémiques d'oiseaux d'Hawaii, qui avaient évolué, en son absence, sans défense contre ce dernier[53].
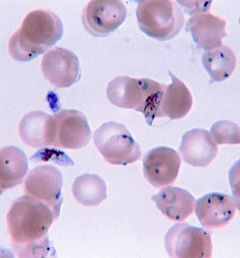
Le Plasmodium se présente sous la forme d'un protozoaire particulièrement petit (1 à 2 µ selon les formes). La coloration au May-Grünwald-Giemsa montre qu'il est constitué d'un cytoplasme bleu pâle entourant une vacuole nutritive claire et contenant un noyau rouge et du pigment brun-doré ou noir (hémozoïne).
Le cycle évolutif du Plasmodium est assez complexe et nécessite deux hôtes, un hôte définitif : l'homme et un hôte primaire : la femelle hématophage d'un moustique du genre Anopheles (du grec anôphelês signifiant : inutile). D'un point de vue strictement biologique, le véritable hôte définitif est le moustique (la reproduction sexuée parasitant l'anophèle). L'homme ne serait qu'un hôte intermédiaire dans son cycle réplicatif. Néanmoins, pour des raisons anthropocentriques, on considère que le vecteur n'est pas l'homme mais le moustique et donc que cette zoonose est du type zooanthroponose.
L'anophèle, vecteur du paludisme
Technique de chasse de l'anophèle
Seules les femelles sont hématophages. Les mâles dont les seules activités sont la reproduction de l'espèce et voler de-ci de-là pour se nourrir de jus de plantes et de nectar ne transmettent pas la maladie.
Les femelles anophèles se nourrissent plutôt la nuit, et commencent à chercher leur repas au crépuscule, en continuant au cours de la nuit jusqu'à ce qu'elles l'aient trouvé.
Quand les humains ou les animaux respirent, ils produisent du CO2 et leur corps dégage constamment de la chaleur et de l'humidité (transpiration) mais aussi énormément d'autres substances attractives comme l'acide lactique ou le sébum. Les moustiques, mais aussi d'autres insectes piqueurs, sont capables de détecter toutes ces émanations depuis de longues distances (± 20 m pour le CO2) et sont immédiatement attirés par ces sources. Les moustiques sont aussi, autant, attirés par les vapeurs d'alcool que par les couleurs foncées et plus particulièrement le noir. Pour ce faire, ils volent de-ci de-là (maximum 2 km) en utilisant leurs capteurs.
| Nom de la zoonose | Cause | Transmission | Vecteur |
|---|---|---|---|
|
Le jour |
femelle Ædes |
||
|
Virus |
Le jour |
femelle Ædes |
|
|
Virus |
La nuit |
femelle Culex |
|
|
Virus |
Le jour |
femelle Ædes |
|
|
Paludisme |
Parasite |
La nuit |
femelle Anopheles |
Cycle du parasite chez l'Anophèle
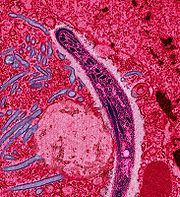
Le vecteur du parasite mais aussi son hôte primaire est la femelle d'un moustique du genre Anophèle. Les jeunes moustiques ingèrent le parasite pour la première fois quand ils se nourrissent du sang (indispensable à cette femelle pour sa production d'œufs) d'un sujet humain infecté. Le moustique infecté transporte ensuite les gamétocytes du Plasmodium dans leurs glandes salivaires. Une fois déglutis, ils passent dans le sang en traversant l'épithélium salivaire pour se différencier en gamètes mâles et femelles qui s'unissent pour former un zygote mobile nommé ookinète qui pénètre la paroi stomacale pour devenir un oocyste sphérique dont le noyau va se diviser sans fin pour former des sporozoïtes. La durée de cette maturation est étroitement dépendante de la température extérieure. Par exemple pour P. falciparum : pas de maturation en dessous de 18 °C ou au-dessus de 35 °C, elle est maximale vers 24 °C. Lorsque l'oocyste rompt, il relâche les sporozoïtes qui migrent dans le corps du moustique jusqu'aux glandes salivaires d'où ils peuvent, lors d'un nouveau repas de sang, infecter un nouvel hôte humain[54], [55], en traversant la peau, avec la salive contenant aussi des anticoagulants et des enzymes.
Cycle du parasite chez l'humain
Phase hépatique
Mince fuseau de 12 µ / 1 µ, le sporozoïte infectieux injecté à l'homme, lors de cette piqûre par une femelle d'anophèle infectée, circule rapidement (moins d'une demi heure) dans le sang jusqu'au foie dans lequel il est sequestré en grande partie grâce aux motifs adhésifs de la protéine majoritaire de son enveloppe (protéine circumsporozoïte ou CSP = Cysteine String Protein), pour ensuite infecter les hépatocytes. Cette crise pré-érythrocytaire hépatique qui va durer 6 jours pour P. falciparum, 8 jours pour P. vivax, 9 jours pour P. ovale et certainement 12 jours pour P. malariæ permettra au parasite de poursuivre son cycle. Les sporozoïtes qui n'atteindront pas le foie seront soit éliminés par les phagocytes, soit incapables de poursuivre leur évolution s'ils atteignent d'autres organes.
Une première transformation arrondit cette forme «cryptozoïte» (du grec κρυπτός (kruptos) signifiant «caché») en un élément uninucléé (avec un seul noyau) nommé trophozoïte qui est l'occasion pour le parasite de se multiplier directement (il en est toujours ainsi pour P. falciparum), par schizogonie, pendant une semaine à quinze jours aboutissant à un énorme schizonte (nom donné au protozoaire quand il devient actif après la phase d'incubation) de 40 à 80 µ. Ce corps bleu (parce que constitué d'un cytoplasme bleu pâle quand il est coloré au May-Grünwald-Giemsa) bourgeonne, tout en perdant de sa mobilité, de façon à émettre des vésicules, contenant les jeunes mérozoïtes qui seront transférés dans le sang, initiant ainsi le stade érythrocytaire, c'est-à-dire l'infection des globules rouges.
Cependant, certains mérozoïtes de P. ovale ou P. vivax peuvent rester cachés dans le foie plusieurs années, ou alors la vie entière pour P. malariæ, avant de se réactiver en vagues successives. Cette phase du parasite est nommée «phase dormante» : le Plasmodium ne se réplique pas mais dort, d'où les noms qui lui sont donnés à ce moment-là : «hypnozoïte» (du grec Ὕπνος qui est Hypnos l'antique dieu grec du sommeil).
Phase de transfert
Les vésicules sont libérées dans les sinusoïdes hépatiques (vaisseaux capillaires du foie faisant la jonction entre ce dernier et le réseau sanguin) pour rejoindre ensuite la circulation sanguine et y répandre un flot de jeunes mérozoïtes «pré-érythrocytaires» prêts à infecter les globules rouges. Chaque cellule de foie infectée contient à peu près 100 000 mérozoïtes (chaque schizonte est capable de produire 20 000 mérozoïtes). C'est une véritable technique de «Cheval de Troie» qui est ici utilisée pour passer des cellules hépatiques au sang. L'imagerie in vivo a montré en 2005-2006 chez des rongeurs que les mérozoïtes étaient capables de fabriquer des cellules mortes leur servant à quitter le foie pour la circulation sanguine en échappant ainsi au dispositif immunitaire). Ils semblent à la fois guider ce «véhicule» et s'y cacher en masquant les signaux biochimiques qui alertent normalement les macrophages. Il y a peut-être là une piste nouvelle pour des médicaments actifs ou un vaccin anti-stade exo-érythrocytaire avant le stade de l'invasion des globules rouges.
Phase sanguine
Au début de la longue phase sanguine[56] : les mérozoïtes s'accolent aux globules rouges, les envahissent, s'y développent en trophozoïtes puis s'y divisent (schizontes). En se diffusant, les mérozoïtes font éclater les globules rouges (c'est l'hémolyse). Ce sont ces éclatements brutaux et synchrones qui sont à l'origine des accès de fièvre. Le temps qui s'écoule entre la pénétration d'un parasite dans un globule rouge et l'éclatement de ce dernier est assez constant et atteint chez l'être humain 48 heures pour P. vivax, P. ovale et P. falciparum (fièvres tierces) et 72 heures pour P. malariæ (fièvre quarte). La destruction des globules rouges provoque une anémie et , dans le cas du paludisme cérébral (voir le sous titre sur ce sujet), la mort intervient suite à une obstruction des vaisseaux sanguins du cerveau par les globules rouges infectés. Cette destruction de globules rouges s'accompagne de la libération d'hémozoïne, qui va perturber le fonctionnement de l'hypothalamus (production de cytokine comme le TNFα) [57] et causer de très fortes fièvres qui peuvent aller jusqu'à l'hyperpyrexie.
L'éclatement des schizontes mûrs ou «rosaces» termine le premier cycle schizogonique érythrocytaire en libérant dans le sang, avec les déchets du métabolisme plasmodial (pigments et débris cellulaires du globule rouge), une nouvelle génération de plasmodiums, les mérozoïtes «érythrocytaires» capables de réinfecter d'autres globules rouges.
Une succession régulière de cycles identiques va suivre, qui seront progressivement remplacés (les défenses immunitaires s'organisant) par des cycles érythrocytaires gamogoniques préparant les formes sexuées. Les trophozoïtes arrêtent de se diviser et modifient leur rapport nucléo-plasmatique. Ces formes de trophozoïtes avec un noyau volumineux et un cytoplasme densifié sont des gamétocytes mâles et femelles, qui vont demeurer en attente dans le sang.
Les parasites lors de cette phase n'ont aucune chance de survie dans l'être humain : ils restent vivants une vingtaine de jours puis disparaissent. Ils ne pourront poursuivre leur évolution que chez le moustique. À ce moment si un anophèle femelle pique une personne malade, il absorbe des gamétocytes contenus dans le sang, et un nouveau cycle, sexué cette fois, commence dans le moustique. Les sporozoïtes produits par cette reproduction passent dans la salive du moustique, qui peut infecter un nouvel hôte, et ainsi de suite...
Remarque
Pour P. Falciparum c'est là tout le cycle de vie. Avec les autres Plasmodium, certains mérozoïtes pré-érythrocytaires, ne gagnent pas le sang directement, mais s'attaquent à de nouveaux hépatocytes : c'est le début des cycles exo-érythrocytaires secondaires qui vont entretenir dans le foie la parasitose pendant deux ou trois ans pour P. Ovale, 3 à 5 ans ou plus pour P. Vivax et au cours de la vie entière pour P. Malariæ.
Animation et schéma du cycle parasitaire du Plasmodium
- Animation Adobe Flash Player
- Schéma
Autres causes de transmission
Les parasites peuvent aussi être transmis par voie placentaire de la mère au fœtus (paludisme congénital), par partage d'une seringue souillée ou par transfusion sanguine, quoique ce dernier moyen de transmission soit assez rare[58].
Diagnostic
Symptômes
- Exprimés par le patient :
- Fatigue généralisée,
- perte d'appétit,
- vertiges,
- céphalées,
- troubles digestifs (embarras gastrique), nausées, vomissements, douleurs abdominales,
- diarrhée,
- myalgies.
- Recherchés par le professionnel de la santé :
- fièvre,
- tremblements intermittents,
- arthralgies,
- nausées et vomissements,
- signes d'anémie causée par l'hémolyse,
- hémoglobinurie,
- convulsions,
- ictère.
Des sensations de picotements peuvent, aussi, apparaitre dans la peau, surtout lorsque le paludisme est causé par P. falciparum. Le symptôme le plus classique du paludisme est la répétition cyclique d'une sensation de froid soudaine suivie de frissons avec fièvre et hyperhidrose durant quatre à six heures, survenant l'ensemble des 48 heures lors des infections dues à P. falciparum, P. vivax et P. ovale, ou l'ensemble des 72 heures pour celles dues à P. malariæ[59] (cependant, P. falciparum peut entrainer des fièvres l'ensemble des 36 à 48 heures ou une fièvre continue et moins prononcée). Le paludisme grave est causé quasi exclusivement par les infections de P. falciparum et survient le plus souvent 6 à 14 jours après l'infection[60]. Ce type de paludisme peut entrainer le coma et la mort s'il n'est pas traité, en particulier chez les jeunes enfants et les femmes enceintes qui sont spécifiquement vulnérables. D'autres symptômes incluent une splénomégalie, une hépatomégalie et des céphalées sévères qui seront corroborés par une ischémie cérébrale, de l'hypoglycémie mais aussi des problèmes rénaux lors des examens cliniques. Si les reins cessent de fonctionner, une fièvre spécifique peut survenir, quand l'hémoglobine des globules rouges fuit dans l'urine. Le paludisme sévère peut progresser extrêmement rapidement et causer la mort en quelques jours ou alors quelques heures[60] d'où l'intérêt d'un diagnostic réellement empirique et rapide. Dans les cas les plus graves, le taux de mortalité peut dépasser 20 %, même avec des soins importants[61]
Pour des raisons toujours peu comprises, mais pouvant être liées à la pression intracrânienne, les enfants atteints du paludisme ont quelquefois une posture anormale en extension (posture opisthotonique), indiquant un paludisme cérébral[62]. Ce paludisme peut entrainer des retards cognitifs car il cause une anémie générale pendant une période de développement cérébral rapide induisant des dommages neurologiques auquels les enfants sont plus vulnérables[63], [64] et , ainsi, causer, à plus long terme, des problèmes de développement[65].
Anamnèse
Dans de nombreux lieux, même un simple diagnostic en laboratoire n'est pas envisageable et l'historique des fièvres est utilisé comme indication pour poursuivre un traitement antipaludique ou non. Mais cette méthode n'est pas la plus efficace : au Malawi, l'utilisation de frottis sanguin colorés par Giemsa a montré que les traitements antipaludiques inutiles ont diminué lorsque les indicateurs cliniques (température rectale, pâleur du lit des ongles, splénomégalie) ont été utilisés plutôt que l'historique des fièvres (la sensibilité s'est accrue de 21 à 41 %) [66].
Le paludisme concernant les enfants est trop fréquemment soit mal diagnostiqué (mauvaise anamnèse, mauvaise interprétation des tests de terrain) en 1re ligne par les auxiliaires médicaux locaux («Community Health Workers» aussi nommés «Barefoot doctors» en anglais) [67], à la place d'autres maladies, soit mal évalué, par ceux-ci, en termes de dose médicamenteuse empêchant, ainsi, un traitement efficace, [68].
Examen clinique
Les manifestations cliniques du paludisme n'apparaissent qu'au cours de la multiplication asexuée des plasmodiums au sein des hématies faisant du paludisme, au sens propre, une érythrocytopathie parasitaire. Cette dernière aboutit à :
- des accès fébriles violents et rythmés ;
- une destruction massive d'hématies (directe et indirecte) qui entraîne une anémie hémolytique et réaction du SRH (splénomégalie progressive) ;
- une biligénie pigmentaire, d'où subictère (et hépatomégalie de reprise) ;
- une détérioration de l'état général pouvant aboutir à la cachexie.
L'étude des cycles (voir plus haut) sert à comprendre le déroulement d'un paludisme non traité.
Les 6 à 10 accès constituant l'atteinte de primoinvasion seront suivis d'atteintes identiques de recrudescence tant que durera l'état latent la parasitémie responsable de la première atteinte, soit de deux mois à deux ans selon le plasmodium. Pour P. Falciparum les choses s'arrêteront là.
Pour les plasmodiums récurrents (P. Vivax, P. Ovale et P. Malariæ) de nouvelles atteintes de récurrence dues à des réinfestations sanguines au départ des cycles hépatiques exoérythrocytaires secondaires peuvent prolonger l'affection dans les délais déjà indiqués. Les atteintes typiquement rythmées de la forme classique, n'apparaissent plus guère actuellement, même dans la zone d'endémie à cause de l'emploi généralisé des drogues chimiothérapiques et chimioprophylactiques. Elles se rencontrent toujours dans les «paludismes à la seringue» dont on respecte l'évolution normale dans un but thérapeutique (malariathérapie) et dans les paludismes récurrents.
Des enquêtes récentes suggèrent que la rétinopathie malariale pourrait être meilleure que les autres méthodes pour distinguer le coma paludique et non-paludique[69].
|
||||||||||||||||||||
| (* en cas d'insuffisance de prophylaxie anti-malarique) |
Examens complémentaires
Examen sanguin au microscope
La méthode de diagnostic la moins chère (entre 0, 40 et 0, 70US par lame), la plus fiable et la plus commune est l'examen au microscope optique d'un frottis sanguin et d'une goutte épaisse de sang. Le frottis permet d'identifier les caractéristiques uniques de chacune des quatre espèces du parasite d'Homo sapiens car l'aspect du parasite est mieux conservé avec ce prélèvement. La goutte de sang épaisse sert à parcourir un volume sanguin plus large pour faire le diagnostic et de ne pas passer à côté de Plasmodium. La sensibilité de la goutte épaisse est à peu près 11 fois plus élevée que la méthode par plaque fine (frottis). Les deux préparations peuvent être faites sur la même lame pour tout autant qu'on commence par le frottis[70].
Des niveaux d'infection plus bas peuvent être détectés avec la goutte épaisse mais l'apparence du parasite est déformée et il est plus complexe de distinguer les espèces. Les deux méthodes sont par conséquent utilisées pour un diagnostic complet[71]. Avec cette goutte épaisse, un opérateur expérimenté peut, dans de bonnes conditions (éclairage direct électrique), détecter des niveaux de parasitémie particulièrement bas (de l'ordre de 0, 0001 % des globules rouges) [72]. De nombreuses tentatives ont été faites pour perfectionner l'examen microscopique, mais aucune ne s'est avérée supérieure à la méthode classique de coloration Giemsa et d'examen en immersion d'huile (la lentille frontale du microscope baigne dans un liquide d'indice de réfraction proche de celui du verre comme l'huile de cèdre ou une huile de synthèse).
Le diagnostic au microscope peut, en outre, être complexe car les premiers trophozoïtes («en anneau») des quatre espèces ont une apparence presque semblable. L'identification de l'espèce doit, alors, toujours se baser sur plusieurs trophozoïtes.
Tests de terrain
Quand un microscope n'est pas disponible ou qu'il y a trop peu de personnel médical constitué au diagnostic du paludisme, il est envisageable d'utiliser des tests de détection rapide d'antigènes, qui n'ont besoin que d'une goutte de sang[73]. Ces tests immunochromatographiques (aussi nommés tests de diagnostic rapide du paludisme ou TDR) [74] peuvent se présenter sous la forme d'une cassette, d'une bandelette réactive ou d'un «dipstick». Ces tests utilisent une goutte de sang du doigt ou d'une veine, ils durent 15 à 20 minutes si l'utilisateur a été préalablement constitué à leur maniement ainsi qu'à l'interprétation du résultat sinon, ils devront être transportés en caisson réfrigéré vers un laboratoire. La limite de détection avec ces tests est de l'ordre de 100 parasites par microlitre (µl) de sang, contre 5 par le dépistage au microscope.
Les premiers tests rapides utilisaient le glutamate déhydrogénase (GluDH) de P. falciparum comme antigène cible (PGluDH) [75] mais il a été vite remplacé par le lactate déshydrogénase (LDH) de P. falciparum (PLDH). C'est la dernière enzyme du parcours glycolytique (principale pour la génération d'ATP) et une des plus abondantes générées par P. falciparum. La concentration de PLDH sanguin est assez étroitement corrélée à la présences des parasites. La disparition de l'antigène après le traitement permet d'utiliser le test pLDH pour prédire le succès ou non d'un traitement.
Il existe des dizaines de TDR ayant chacun leur (s) spécificité (s) :
- l'Optimal IT® sert à distinguer P. falciparum et P. vivax grâce aux différences antigéniques entre les isœnzymes pLDH ; ce test sert à détecter P. falciparum jusqu'à une parasitémie de 0, 01 %, et les non-falciparum jusqu'à 0, 1 % ;
- le ParaCheck Pf® peut détecter des parasitémies de 0, 002 % mais ne distingue pas les espèces ;
- d'autres comme ICT Malaria® ou ParaHIT® sont centrés sur l'antigène HRP2[76].
Méthode moléculaire en laboratoire
Des méthodes moléculaires sont disponibles dans certains laboratoires. Ces méthodes d'analyse en temps réel (comme la PCR en temps réel, basée sur la réaction en chaîne par polymérase) sont en développement dans l'espoir de les mettre en place dans les zones endémiques[77]
Les acides nucléiques des parasites sont détectés par réaction en chaîne par polymérase (PCR), une technique plus précise que la microscopie, mais également plus chère car demandant un laboratoire spécialisé, une idéale maitrise de la méthode de prélèvement de l'échantillon et , s'il y a lieu, un respect de la chaine du froid irréprochable au cours du stockage et le transport. De plus, les niveaux de parasitémie ne sont pas obligatoirement corrélés avec la progression de la maladie, surtout lorsque le parasite peut adhérer aux parois des vaisseaux sanguins, d'où l'intérêt des méthodes moins avancées.
Les différents types de paludisme
Les complications graves ne concernent généralement que Plasmodium falciparum.
Le paludisme chronique peut être causé par P. vivax, P. ovale et en particulier P. malariæ mais pas par P. falciparum. Dans le cas du paludisme chronique, la maladie peut réapparaitre plusieurs mois ou années après l'exposition, à cause de la présence latente de parasites dans le foie. Ainsi, on ne peut pas dire qu'un sujet est guéri du paludisme simplement en observant la disparition des parasites du flux sanguin. La période d'incubation la plus longue rapportée pour P. vivax est de 30 ans[60]. À peu près un cas de paludisme P. vivax sur cinq dans les zones tempérées implique l'hibernation par les hypnozoites (les rechutes débutent l'année après la piqûre du moustique) [78].
Accès palustres simples
La «crise de paludisme», nommée aussi «accès palustre», peut être suspectée au retour d'une zone d'endémie et est caractérisée par des accès fébriles, avec une fièvre à plus de 40 °C, des frissons, suivis d'une chute de température accompagnée de sueurs abondantes et d'une sensation de froid.
Classiquement, on distingue la fièvre tierce (c'est-à-dire survenant l'ensemble des deux jours) due à Plasmodium vivax et Plasmodium ovale (fièvre tierce bénigne) et Plasmodium falciparum (fièvre tierce maligne) de la fièvre quarte (c'est-à-dire survenant l'ensemble des 3 jours) due à Plasmodium malariæ (le terme «malaria» désignait particulièrement la fièvre quarte).
Ces accès palustres peuvent se répéter pendant des mois ou alors des années avec P. ovale, P. vivax et P. malariæ, mais pas avec P. falciparum, s'ils sont correctement traités et en l'absence de réinfestation (cas du paludisme d'importation, généralement).
Paludisme viscéral évolutif
Jadis nommée cachexie palustre, associant fièvre intermittente modérée, anémie et cytopénie, splénomégalie modérée chez des enfants de 2 à 5 ans. Dans le paludisme viscéral évolutif, l'organisme est visiblement débordé, et il faut le défendre à tout prix en s'attaquant successivement aux formes sanguines et tissulaires :
- Chloroquine (Nivaquine*) 600 mg (2 comprimés à 0, 30 g) par jour les 2 premiers jours, puis 300 mg (1 comprimé à 0, 30 g) par jour les 3 jours suivants puis,
- Primaquine* 15 mg (3 comprimés à 0, 5 mg) par jour pendant 15 jours, soit du 6e au 20e jour inclus.
Il faut surveiller les signes d'intolérance aux 8-ammino-quinoléïnes (vertiges, nausées, diarrhée, cyanose, hémoglobinurie, agranulocytose) quoiqu'ils soient rares à cette posologie.
La néphrite quartane
Le plasmodium malariæ est susceptible d'entraîner une infection à répétition (ou chronique) attaquant les glomérules, à l'origine d'un syndrome néphrotique par la dissolution de complexes immunitaires (associations anticorps-antigène). L'ensemble des sujets présentant une infection répétée par plasmodium malariæ ne présentent pas une atteinte rénale. L'examen au microscope électronique des prélèvements rénaux permet d'identifier la lésion. Cet examen met en évidence des dépôts de complément (éléments intervenant dans le dispositif immunitaire) et d'immunoglobulines (variété de protéines jouant le rôle d'anticorps). Le laboratoire détecte chez l'enfant des antigènes de plasmodium malariæ. Le pronostic est meilleur lorsqu'il s'agit de dépôts immunofluorescents à prédominance d'IgG3 et de granulation grossière avec protéinurie sélective (les reins ne laissent passer qu'une certaine variété de protéines et non pas toutes). Les sujets présentant des dépôts fins granuleux à prédominance d'IgG2 et une protéinurie non sélective (les reins laissent passer l'ensemble des protéines) ont un moins bon pronostic. Traitement : la néphrite quartane ne répond pas forcément aux traitements antipaludiques ni aux corticoïdes ainsi qu'aux médicaments cytotoxiques.
Accès palustres graves à Plasmodium falciparum
Paludisme cérébral ou neuropaludisme
Cette malaria cérébrale, nommée ainsi à cause de l'obstruction des capillaires du cerveau par les débris d'hématies éclatées, associe une élévation importante de la température (40 °C) et un coma (d'une durée fréquemment supérieure à 30 minutes). Elle est de mauvais pronostic malgré le traitement. La mortalité s'élève quelquefois à 20 % chez les adultes et 15 % chez les enfants. La naissance d'une telle malaria sévère peut être soit progressive soit brutale.
Elle commence après des convulsions instantanées et passagères d'un ou plusieurs muscles, suivies de décontractions. Ces convulsions sont situées ou généralisées à la totalité du corps. Elles surviennent principalement chez les enfants et les femmes enceintes et dans uniquement 50 % des cas chez les autres adultes. Cela est du à un mauvais fonctionnement du foie ainsi qu'à une consommation exagérée de sucre par le parasite. Les femmes enceintes sont spécifiquement prédisposées à l'hypoglycémie ainsi qu'à la surproduction d'acide lactique entrainant une augmentation de l'acidité du sang.
L'examen physique complémentaire montrera aussi (tous ou une partie) des symptômes suivants :
- un nystagmus dans le plan horizontal de façon incessante,
- parfois une raideur du cou et une perturbation des réflexes,
- dans à peu près 15 % des cas, il existe des hémorragies de la rétine,
- un ictère,
- une posture opisthotonique (en extension) n
- des urine de couleur noire,
- une hématémèse due probablement à une atteinte de l'estomac par ulcération due au stress.
L'examen de laboratoire mettra en évidence :
- un œdème pulmonaire qui n'est pas bien expliqué mais peut être à l'origine d'un taux de mortalité dépassant 80 %,
- une atteinte des reins (plus rare chez l'enfant mais s'accompagnant aussi d'une forte mortalité). Son mécanisme n'est pas non plus éclairci,
- une anémie qui est le résultat de la destruction et de l'élimination accélérée des globules rouges par la rate, associées à un déficit de production de ces globules par la mœlle osseuse (aplasie médullaire). Elle nécessite le plus souvent une transfusion. Celle-ci pose des problèmes chez l'enfant et est à l'origine de la présence d'hémoglobine dans le sang, d'urine de coloration noire et de l'insuffisance de fonctionnement des reins.
Une autre complication susceptible de survenir au cours de cette variété de la malaria est la fièvre bilieuse hémoglobinurique.
La fièvre bilieuse hémoglobinurique
Complication aujourd'hui rarissime survenant chez des individus anciennement atteints de la malaria à Plasmodium falciparum vivant dans les pays de forte endémie (où une grande partie de la population est touchée) et liée à la prise de quinine ou d'autres molécules de synthèse comme l'halofantrine (dérivé phénanthrène-méthanol) (Halfan®). Elle est consécutive à un éclatement des globules rouges au sein des vaisseaux (hémolyse intra-vasculaire).
L'examen clinique caractérisera :
- une fièvre élevée,
- un état de choc avec prostration,
- un ictère,
- des urines de plus en plus foncées contenant des cylindres hyalins (vitreux).
Tandis que l'examen de laboratoire mettra en évidence :
- une anémie,
- une hémoglobinurie (présence d'hémoglobine dans les urines, leur donnant une couleur porto),
et en particulier
- une insuffisance rénale mortelle due à une destruction des tubules rénaux (tubes entortillés des pôles urinaires) nommée nécrose tubulaire aiguë.
C'est une urgence médicale car reconnue comme un accès pernicieux. Le traitement aura 3 buts :
- maîtriser l'oligo-anurie (diminution ou alors disparition de l'émission d'urine par les reins),
- déparasiter le malade,
- traiter l'anémie hémolytique.
Contre l'oligo-anurie : la dialyse péritonéale permettra de franchir la phase critique en attendant le rétablissement de la diurèse.
Contre la parasitémie, un véto absolu contre la quinine, ici complètement contre-indiquée à cause de l'hémolyse mais aussi contre les sulfamidés à cause de la tubulopathie rénale (maladie affectant les néphrons). On se contentera de chloroquine (Nivaquine®) à raison d'une injection unique de 300 mg par voie intramusculaire.
Contre l'anémie hémolytique, on pratiquera au choix des transfusions, fermement isogroupes (sang de même groupe ABO), ou des exsanguino-transfusions.
La malaria de la femme enceinte
L'infection du placenta par le plasmodium falciparum se traduit par un poids de naissance faible, tout spécifiquement lorsque c'est un premier accouchement (primipare).
Lorsque la quantité de parasites dans le sang est assez peu importante (c'est le cas dans les zones de transmission stable), les femmes ne présentent pas de signes tandis que les parasites qui envahissent les globules rouges de la circulation, et plus exactement de la petite circulation du placenta, sont présents. Dans les zones où la transmission est instable (on parle d'hypo ou de méso-endémie), les femmes enceintes présentent des infections sévères associées à des quantités élevées de parasites dans le sang avec une anémie, une hypoglycémie et des œdèmes des poumons. La grossesse est alors émaillée de problèmes à type de contractions prématurées, d'avortement spontané et de mortalité au moment de l'accouchement. La malaria congénitale touche à peu près 5 % des nouveau-nés de mères infectées et est en relation directe avec la quantité de parasites dans le placenta.
La malaria transfusionnelle
C'est une malaria transmise par l'intermédiaire d'une transfusion sanguine ou après échange d'aiguilles entre individus drogués. P. malariæ et P. falciparum sont le plus fréquemment mis en cause. Dans ce cas, la période d'incubation est courte car il n'existe pas de cycle pré-érythrocytaire (se déroulant avant l'envahissement des globules rouges). La malaria transfusionnelle se traduit par les mêmes signes que ceux qu'on observe par le Plasmodium en cause. Néanmoins, P. falciparum est le plus fréquemment sévère chez les toxicomanes. Le traitement, qui utilise le primaquine lorsque c'est une infection à P. ovale ou P. vivax, est alors inutile, du fait de la différence du cycle de transmission de la malaria transfusionnelle.
La malaria de l'enfant due à falciparum
Au départ d'environ 1 à 3 millions de décès chaque année, cette variété de la malaria touche principalement les Africains et s'accompagne de :
- troubles neurologiques avec des convulsions pouvant aller jusqu'au coma,
- hypoglycémie,
- augmentation du taux d'acidité du sang (acidose métabolique),
- anémie sévère.
Contrairement aux autres formes de la malaria, la malaria de l'enfant ne s'accompagne pas ou peu fréquemment d'une atteinte rénale à type d'insuffisance de filtration des reins (insuffisance rénale) ni d'une collection liquidienne dans les poumons (œdème pulmonaire aigu). Dans cette variété de la malaria, le traitement est le plus souvent efficace et rapide.
La splénomégalie tropicale
Dénommée aujourd'hui splénomégalie palustre hyper-immune, cette splénomégalie se rencontre chez quelques individus qui vivent dans une zone où la malaria est endémique. Ces personnes présentent une réponse immunologique anormale aux infections dues à la malaria, ce qui se traduit, en dehors de la splénomégalie, par une hépatomégalie, l'élévation d'un certain type d'immunoglobulines dans le sang (IgM, anticorps anti-palustres) et du nombre de lymphocytes au sein des sinusoïdes hépatiques.
La biopsie du foie et l'examen au microscope optique permettent de porter le diagnostic.
Les symptômes sont :
- tiraillement abdominal,
- présence d'une masse abdominale,
- douleurs abdominales violentes (péri-spléniques : inflammation des tissus environnant la rate),
- anémie,
- le labo ne montre pas la présence de parasites dans le sang.
Infections à répétition :
Complications : taux de mortalité élevé, prolifération des lymphocytes avec apparition d'un syndrome lymphoprolifératif malin susceptible de se développer chez les individus présentant une résistance au traitement antipaludique
Des défenses pour l'hôte
L'immunité
Après plusieurs années d'infections répétées, l'hôte du Plasmodium peut acquérir une immunité, nommée prémunition (symptômes atténués d'une maladie qui protège contre une infection ultérieure de type sévère). On constate une grande variabilité des réponses à l'infection palustre entre des individus vivant dans les mêmes zones d'endémie. Dans des régions où la transmission est forte, une grande proportion des enfants sont fréquemment porteur de parasites de P. falciparum sans déclarer aucun symptôme ; c'est l'immunité clinique. Avec l'âge et les contacts successifs être humain/parasite s'installe progressivement cette prémunition, qui fait appel à des mécanismes de résistance à l'infection parmi lesquels les protéines «interférons» métabolisées et excrétées, entre autres, par le foie jouent un rôle majeur dans l'immunité anti-parasite. On parlera, alors, de tolérance à l'infection ou d'immunité anti-parasite.
On dit fréquemment que cette immunité n'est pas stérilisante car il n'a jamais été démontré de façon formelle de disparition totale des parasites de P. falciparum en l'absence de traitement. On dit aussi que cette immunité est labile car la prémunition disparait en l'absence de contacts habituels entre l'être humain et le parasite (elle disparait après 12 à 24 mois si le sujet quitte la zone d'endémie) mais aussi chez la femme enceinte.
D'autre part, l'immunité dirigée contre P. falciparum est fortement spécifique de l'ou des souches[79] parasitaires présentes.
Ces particularités de la réponse immunitaire contre le paludisme sont à l'origine des difficultés pour élaborer un vaccin.
Les facteurs génétiques
Des facteurs génétiques peuvent protéger contre le paludisme. L'essentiel de ceux qui ont été décrits sont associés aux globules rouges. En voici quelques exemples :
- La drépanocytose (du grec drepanos, «faucille» au regard de la forme allongée qu'ont un certain nombre d'hématies -ou globules rouges) aussi nommée hémoglobinose S, sicklémie, ou anémie falciforme : une modification dans la chaîne ß de l'hémoglobine entraîne une déformation des globules rouges, ce qui produit des hétérozygotes qui protègent mieux contre le paludisme. Les hématies sont déformées et l'hémoglobine cristallise, ce qui empêche le parasite de rentrer dans le globule rouge (ou hématie). Ce changement entraîne cependant une mauvaise oxygénation des organes (les hématies allongées ne peuvent passer dans les fins capillaires ni la barrière que forme le filtre de la rate où elles sont détruites) et , par conséquent, de sévères complications, allant jusqu'au décès pour les sujets homozygotes (HbS/HbS). La prévalence de la drépanocytose (HbA/HbS) est élevée dans les populations africaines soumises a une forte pression du paludisme à cause de la résistance qu'elle procure contre les accès graves de la maladie.
- La thalassémie ou anémie héréditaire : le sujet est porteur du gène SS entraînant une modification des taux de synthèse des chaînes de globines avec pour conséquence une mauvaise circulation du sang et une fatigue constante.
- Le déficit génétique en G6PD (Glucose-6-phosphate déshydrogénase) nommé aussi favisme, qui est une enzyme antioxydante protégeant normalement contre les effets du stress oxydatif dans les globules rouges, donne une protection accrue contre le paludisme grave.
- Le HLA-B53 est associée à un faible risque de paludisme grave. Cette molécule CMH (complexe majeur d'histocompatibilité) de classe I présente dans le foie est un antigène des lymphocytes T (car localisées dans le thymus) contre le stade sporozoïte. Cet antigène, encodé par IL4 (Interleukin-4), produit par les cellules T (thymus), facilite la prolifération et la différenciation de la production d'anticorps-cellules B. Une étude des Peuls du Burkina Faso, qui ont moins de deux attaques de paludisme avec des niveaux plus élevés d'anticorps antipaludiques que les groupes ethniques voisins, a constaté que l'allèle IL4-524 T était associé à des niveaux élevés d'anticorps contre le paludisme, ce qui soulève la possibilité que ce pourrait être un facteur d'augmentation de la résistance au paludisme.
- Les sujets dont les érythrocytes (c'est-à-dire les globules rouges) sont dépourvus de certains antigènes de groupes sanguins, sujets FY (-1, -2, -3, -6) dans la classification des dispositifs immunogènes FY (anciennement dispositif Duffy), ne peuvent être contaminés par P. vivax ni par P. knowlesi (de découverte récente et apparenté à P. malariæ). Il s'agit là d'un exemple d'avantage sélectif de la population ouest-africaine, où ce groupe sanguin est particulièrement habituel.
D'autres facteurs génétiques existent dont certains sont impliqués dans le contrôle de la réponse immunitaire.
Traitements
Dans les zones endémiques, les traitements sont fréquemment peu satisfaisants et le taux de mortalité global pour l'ensemble des cas de paludisme peut atteindre un sur dix[80]. L'utilisation massive de thérapies dépassées[81], de faux médicaments et la mauvaise anamnèse des symptômes sont responsables du mauvais bilan clinique.
Les anciens traitements
On peut combattre le parasite en appliquant différentes molécules soit en traitements curatifs soit en prophylaxie. Ces différents traitements sont plus ou moins efficaces suivant les régions et les taux de résistances contractés car, tout comme le DDT (insecticide le plus utilisé dans les années 1960), les médicaments efficaces il y a 30 ans, ne le sont plus actuellement. Pourtant, ces formulations obsolètes sont toujours massivement utilisées dans les pays touchés[82].
En effet, ces pays sont surtout pauvres et n'ont par conséquent pas les moyens de migrer leur protocole de soins vers un outil plus onéreux comme l'utilisation des ACT (Artemisinin-based combination therapy : combinaisons à base d'artémisinine). Pendant longtemps, les traitements faisaient appel à la chloroquine, la quinine et la SP (sulfadoxine-pyriméthamine) et dans une moindre mesure la méfloquine, l'amodiaquine et la doxycycline. Ces molécules furent des armes particulièrement efficaces pour lutter contre les parasites du paludisme mais leur prescription sans contrôle a favorisé l'émergence de souches résistantes. Selon l'OMS, un traitement est efficace si le taux d'échec est inférieur à 5 % ; s'il dépasse 25 %, il faut changer de protocole.
La chloroquine a longtemps été administrée en priorité pour soigner les patients. C'était un médicament qui présentait de nombreux avantages, surtout son faible coût et l'absence d'effets secondaires. Actuellement, malheureusement, les soins à base de chloroquine échouent à plus de 25 % dans la majorité des pays africains touchés par le paludisme. Or, on continue, malgré tout, à les employer.
À l'endroit où la chloroquine n'a plus d'effet, on utilise un médicament nommé «médicament de deuxième intention» : la SP (comme le Fansidar® produit par Roche). Cette molécule contourne la résistance à la chloroquine. Cinq ans uniquement ont suffi pour que des souches résistantes apparaissent. On adapte alors le traitement en recourant à un «médicament de 3e intention» : la quinine, administrée per os dans les cas bénins, par perfusion dans les cas aigus. Mais on se rend compte à présent que ce traitement est lui aussi confronté à de nouvelles résistances.
Cette résistance est due à la mutation d'un gène du Plasmodium, le PfCRT (Plasmodium falciparum Chloroquine Resistance Transporter). Cette mutation draine la chloroquine hors de la cellule infectée mais entraînerait cependant une moins bonne adaptation du parasite à son milieu. [83] Le Malawi est le premier pays africain à avoir abandonné la chloroquine dès 1993, conduisant à une réapparition des souches sensibles qui redeviennent alors hautement majoritaire. [84]
Les ACT
Face au paludisme, il n'existe, en 2006[85], qu'un seul traitement véritablement efficace : les ACT (Artemisinin-based combination therapy : combinaisons à base d'artémisinine) tous obligatoirement génériques. Un traitement recommandé par l'OMS mais qui reste toujours cher. Quoique des résistances de Plasmodium falciparum à l'artémisinine ont pu être produites en laboratoire[86], démontrant ainsi la possibilité d'une telle complication, à l'état naturel aucune résistance n'est pour le moment répertoriée en trithérapie associant le SP (sulfadoxine-pyriméthamine). Le principal inconvénient reste son prix, qui le rend inaccessible pour de nombreux pays en voie de développement.
L'OMS et le groupe pharmaceutique Novartis, fabricant de l'artéméther (dérivé semi-synthétique de l'artémisinine) -luméfantrine (molécule synthétique antimalarique) commercialisé sous le nom de Co-artem®, ont conclu un accord au terme duquel Novartis apporte le médicament au prix de revient (0, 9 et 2, 4 USD pour les traitements enfant et adulte respectivement). C'est un comprimé jaune rond et plat, aux bords chanfreinés et pourvu d'une barre de cassure sur une face. "N/C" est gravé sur une face et "CG" sur l'autre. Lors de la prise, il est conseillé de consommer une boisson forte en lipides (lait) et de continuer à s'alimenter pour favoriser l'absorption de la luméfantrine. Pour un sujet dont le poids est supérieur ou égal à 35 kg, une première prise de 4 comprimés immédiatement après le diagnostic, une seconde à + 8h, puis 4 comprimés 2 fois par jour pendant les 2 jours suivants. A noter que le Co-artem® est commercialisé sous le nom de Riamet® dans les pays développés. Seul le prix change (38, 05 EUR la boîte de 12 comprimés - prix 2009 en Belgique).
D'autres initiatives comme la DNDi (Drugs for Neglected Diseases initiative) créée par MSF et le groupe Sanofi-Aventis ont vu le jour pour aboutir à la fabrication de l'Asaq® [87] à base d'artésunate et d'amodiaquine. La dose fixe coûte moins de 38 centimes d'euro pour les enfants de moins de 5 ans et moins de 77 centimes d'euros pour les adolescents et les adultes.
De nouveaux ACT arrivent sur le marché : dihydroartémésinine-pipéraquine commercialisé sous le nom de Eurartekin® ou Duocotexin® et l'artémésinine-pipératique commercialisé sous le nom de Artequick®.
L'artémisinine (qing hao su ??? en chinois), issue d'Artemisia annua une plante d'origine chinoise (qing hao (??) en chinois), a beaucoup prouvé son efficacité en Asie. Des études menées en laboratoire et dans de nombreux pays impaludés démontrent à la fois son efficacité et sa facilité d'administration. Elle élimine plus rapidement les parasites présents dans le sang.
La prescription d'artémisinine, sous forme d'infusions issues d'armoise annuelle (Artemisia annua) peut s'avérer particulièrement efficace. Cependant, et quoique ce remède soit habituellement employé avec succès en Chine depuis des millénaires, l'élargissement de son utilisation systématique à des zones biogéographiques particulièrement vastes et différentes (par exemple à la plus grande part de l'Afrique sub-saharienne) est sujette à d'importantes mesures de précaution, surtout recommandées en 2006 par l'OMS : il faudrait à tout prix éviter l'irréversible sélection de souches résistantes résultant d'une monothérapie et/ou de dosages incontrôlés. Malgré cela, en mai 2009 deux études indépendantes, menées au Cambodge et en Thaïlande, ont rapporté pour la première fois une augmentation significative de la résistance, in vivo, (avec et sans modification génétique) de P. falciparum (PfMDR1 = P. falciparum multidrug-resistance gene) à l'artémisinine en monothérapie ou, en bithérapie, associée à la méfloquine, et ce, certainement en conséquence de pratiques et de traitements incorrects[88], [89]. Les dosages incontrôlés sont inhérents à toute préparation issue de plantes, puisque les conditions météorologiques, les qualités des sols, ou les protocoles de récolte, fréquemment artisanaux, sont imprévisibles et par conséquent naturellement incontrôlables. Il serait donc particulièrement irresponsable de promouvoir, par exemple, à large échelle la culture de la plante et la monothérapie basée seulement sur l'administration de tisane artisanale d'Artemisia annua qui en dérive. [90]
Pour augmenter son effet, mais également retarder la naissance de résistances, l'artémisinine est par conséquent administrée en association avec une autre molécule, SP (sulfadoxine-pyriméthamine), amodiaquine ou méfloquine : ce sont les ACT (de l'anglais, artemisinin-based combination therapy), combinaisons thérapeutiques associant l'artémisinine à d'autres antipaludiques d'une classe thérapeutique différente. La faible parasitémie résistante à l'artémisinine est éliminée par le deuxième antipaludéen d'action plus durable. Dans les schémas thérapeutiques avec une prescription d'ACT pendant 3 jours, le composé d'artémisinine n'est présent dans l'organisme que durant deux cycles asexués de l'hématozoaire (autre nom donné au protozoaire) (chaque cycle durant 2 jours, sauf pour les infestations à P. malariæ qui dure 3 jours). Cette exposition à 3 jours de traitement par l'artémisinine diminué le nombre de plasmodies (nom donné au protozoaire du Plasmodium) présentes dans l'organisme d'un facteur approximativement égal à 100 millions. Cependant, l'élimination complète des plasmodies repose sur l'efficacité de la SP associée, qui doit persister à des concentrations parasiticides jusqu'à ce que l'ensemble des hématozoaires infestants aient été tués. Ainsi, ceux-ci doivent être éliminés assez lentement. Le résultat est que le composé d'artémisinine est «protégé» de la résistance par le médicament qui l'accompagne pour tout autant que ce dernier soit efficace, et ce médicament d'accompagnement est lui-même partiellement protégé par le dérivé de l'artémisinine. Les schémas thérapeutiques d'ACT d'un ou deux jours ne sont pas recommandées ; ils sont moins efficaces et confèrent une protection moindre pour l'antipaludique s'éliminant lentement.
En 2002, l'OMS a publié une recommandation claire sur l'obligation d'utiliser les ACT dans les pays touchés par les résistances aux antipaludéens classiques. Sur l'avis d'experts internationaux, elle recommande l'introduction de polythérapies pour remplacer les monothérapies dans le traitement du paludisme et préconise surtout le recours à des associations médicamenteuses contenant des dérivés d'artémisinine.
Cependant, une monothérapie (à base d'artémisinine, d'artésunate ou d'arthéméther mais aussi leur métabolite commun : la dihydroartémisinine) administrée sous forme de Rectocap™ [91] (artésunate en gel enrobé de gélatine pour former un suppositoire résistant aux manipulations ainsi qu'à la chaleur) de 200 mg. peut s'avérer spécifiquement utile lorsque les patients sont incapables d'ingérer (vomissements répétés, impossibilité de manger/boire/téter, convulsions récurrentes, absence de réactions à la douleur, coma, absence de réactions psychomotrices) ou lorsque les présentations injectables ne sont pas disponibles ou qu'elles sont impossibles à administrer. Cette monothérapie (monodose (minimum 8, 5 mg/kg) de 10 mg/kg est ce qui le plus couramment conseillé) induit une réaction parasitaire dans les 12 heures et est supérieure à la quinine dans les 24 heures. Elle doit impérativement être suivie, dès que envisageable, par un traitement avec une association médicamenteuse d'ACT. A noter, aussi, que l'utilisation d'une capsule rectale est préférable à une injection intra-musculaire. Tout le monde est capable de l'appliquer, il n'y a aucun risque d'infection par l'aiguille et la durée de réponse du produit est plus rapide.
Produit en assez faibles quantités, les ACT sont plus cher que la chloroquine. Un traitement de première ligne chloroquine ou SP coûte aujourd'hui entre 0, 2 et 0, 5 USD, tandis qu'un traitement ACT oscille entre 1, 2 et 2, 4 USD, soit cinq à six fois plus. Pour de nombreux patients, cette différence est le prix de leur survie. Un prix que, malheureusement, bien peu de personnes en Afrique peuvent payer. Seule une fabrication à plus grande échelle et , ou une aide financière plus importante des pays riches pourrait faire significativement baisser les coûts de production.
Faux médicaments
De faux médicaments supposément anti-paludéens circulent en Thaïlande, au Viêt Nam, au Cambodge[92] et en Chine[93] ; ils forment une cause importante de la mortalité, qui serait néenmoins évitable[94]. En août 2007, la société pharmaceutique chinoise Holley-Cotec a été obligée de retirer 20.000 doses de son médicament à base d'artémisinine DUO-COTECXIN®[95] au Kenya parce que des contrefaçons, en provenance d'Asie, contenant particulièrement peu d'ingrédients actifs et incapables d'une quelconque thérapie circulaient sur le marché à un prix 5 fois moindre. Il n'existe pas de moyen simple pour les médecins comme pour les patients de distinguer un vrai médicament d'un faux, sans l'aide d'un laboratoire. Les compagnies pharmaceutiques tentent de combattre les faux médicaments en utilisant de nouvelles technologies sécurisant le produit de la source à sa distribution.
Prévention
Les méthodes utilisées pour empêcher la maladie de se répandre, ou pour protéger les habitants des zones endémiques, incluent la prophylaxie par la prise de médicaments, l'éradication des moustiques et la prévention des piqûres de moustiques. Pour que le paludisme puisse exister de façon continue à un lieu, il faut une combinaison de facteurs : forte densité de population, fort taux de transmission des humains aux moustiques et réciproquement. Si un de ces facteurs diminue, le parasite finit par disparaitre, comme en Amérique du Nord et en Europe. Inversement, le parasite peut être réintroduit dans une région et y survivre si ces facteurs y sont réunis.
Il n'existe pas de vaccin à l'heure actuelle contre le paludisme, mais la recherche d'un vaccin est un secteur particulièrement actif.
Certains chercheurs affirment que la prévention du paludisme serait plus efficace financièrement que son traitement à long terme ; mais les frais à engager pour cela sont trop importants pour les plus pauvres. L'économiste Jeffrey Sachs estime mais aussi le paludisme pourrait être contrôlé avec 3 milliards de dollars US par an. Afin d'atteindre les objectifs du millénaire pour le développement, l'argent aujourd'hui alloué à la lutte contre le Sida devrait être réaffecté à la prévention du paludisme, ce qui bénéficierait davantage à l'économie africaine[96].
Certains pays comme le Brésil, l'Érythrée, l'Inde ou le Viêt Nam ont réussi à diminuer le fléau du paludisme. L'analyse de ces programmes montre que de nombreux facteurs ont dû être réunis pour lutter avec succès contre la maladie, qu'il s'agisse des financements, de l'action de l'État et des ONG, ou de l'action concrète des travailleurs sociaux[97].
Les moyens de combattre le moustique ou de s'en protéger
On peut combattre le vecteur du paludisme (l'anophèle femelle) par plusieurs moyens de prévention, qui peuvent s'avérer efficaces s'ils sont bien mis en œuvre.
Le véritable problème de cette prévention est le coût particulièrement élevé des traitements pour les populations touchées. En effet, elle peut être efficace chez les voyageurs, mais les pays en voie de développement, qui sont les principales victimes de cette maladie, peinent à organiser des actions particulièrement efficaces. On peut donner pour preuve l'exemple de l'île de la Réunion où le paludisme sévissait comme dans les autres îles de la région (Madagascar et île Maurice) surtout. La Réunion étant un territoire français d'outre-mer, le problème du coût trop élevé n'existait pas et on a pu éradiquer la malaria de cette île sans difficulté.
Deux modes de prévention sont appliqués dans les pays concernés. Ils visent d'une part à protéger les populations contre les piqûres de moustiques et , d'autre part, à éliminer ces derniers par la mise en place de moyens divers. L'objectif principal de cette prophylaxie est de limiter la population de moustiques vecteurs de la maladie et ainsi de tenter d'éradiquer ce fléau.
Dans les années 1960, la principale méthode utilisée pour éradiquer les anophèles femelles était l'utilisation massive d'insecticides. Le plus utilisé était le DDT (Dichloro-Diphényl-Trichloréthane). Cette méthode porta ses fruits dans de nombreuses régions où le paludisme fut complètement éradiqué. Malheureusement, l'utilisation intensive du DDT a favorisé la sélection de moustiques résistants. Cette résistance a été appelée KDR (Knock Down Resistance : résistance à l'effet de choc). En outre, il peut génèrer intoxications et maladies dans la population comme ce fut le cas en Inde ou il fut utilisé de manière abusive en agriculture. Quoique ce produit soit complètement interdit en Europe depuis 1972 et que, depuis 1992, il est classé par l'OMS comme POP (polluant organique persistant), cette même OMS semble revenir sur sa position en prônant de nouvelles recommandations concernant l'utilisation de ce pesticide (usage exclusif conçu pour la lutte contre le paludisme au sein des bâtiments) [98]. Et néenmoins, incontestablement, le DDT est :
- persistant : sa demi-vie est de 15 ans, c'est-à-dire que si on pulvérise 10 kg dans un champ, 15 ans après, il en restera 5 kg, après 30 ans 2, 5 kg et ainsi de suite ;
- dispersif : on en a retrouvé dans les neiges de l'Arctique ;
- bio cumulatif : les animaux qui en absorbent n'en meurent pas, mais ne parviennent pas à l'éliminer. Ils le stockent dans leurs graisses et on en retrouve de grandes concentrations chez les animaux du sommet de la chaîne alimentaire. Par contre, sa toxicité est sujette à débat quoiqu'une ingestion de 35 g peut être létale pour une personne de 70 kg.
Pour remplacer le DDT, qui s'avère dangereux et de moins en moins efficace, des moyens alternatifs sont envisageables pour combattre le vecteur du paludisme[99] :
- assèchement des marais (sans bouleverser le dispositif écologique), drainage des eaux stagnantes où se développent les larves des anophèles (un vieux pneu abandonné et rempli d'eau par les pluies est suffisant au moustique pour y pondre ses œufs) ;
- lutte anti-larvaire par épandage de pétrole ou d'huile végétale et utilisation d'insecticides solubles répandus à la surface des eaux stagnantes, pour tenter de limiter les naissances d'anophèles ou empêcher les larves de venir respirer à la surface. Mesures fort peu recommandables car complètement anti-écologique ;
- ensemencement des eaux avec des prédateurs des anophèles ou de leurs larves comme certains mollusques ou poissons (tilapias, guppys, gambusies, aphanius) [100] ;
- réintroduction, et protection, des variétés de chiroptères insectivores à l'endroit où elles ont disparu (une chauve-souris peut avaler près de la moitié de son poids en insectes en une nuit) [101] ;
- ciblés à partir du séquençage du génome du moustique[102]. Ce génome offre, entre autres, un catalogue de l'accroissement des gènes de détoxification et des gènes mutants qui codent les protéines visées par les insecticides mais aussi les variations des nucléotides individuels, nommés SNPs (prononcez SNIPS) (single nucleotide polymorphisms) qui se trouvent dans le génome :
- emploi d'insectifuges et d'insecticides ciblés seulement contre l'anophèle ;
- dispersion de mâles anophèles stériles dans la nature ;
- interventions génétiques sur les espèces vectrices ou, dans un avenir indéterminé, avec des vaccins bloquant la transmission en induisant des anticorps empêchant la maturation des stades sexués du parasite chez l'anophèle.
Ces mesures ne sont efficaces que sur un territoire limité. Il est particulièrement complexe de les appliquer à l'échelle d'un continent tel que l'Afrique.
Chacun, à titre individuel, peut éviter les piqûres d'anophèles par des mesures mécaniques, physiques et chimiques : rappelons avant tout que l'anophèle a une activité nocturne, commençant à piquer à la tombée de la nuit, et se reposant la journée dans les habitations.
- installation de moustiquaires (mailles inférieures à 1, 5 mm) imprégnés de perméthrine ou de dérivés de pyréthrinoïde. De plus en plus ces moustiquaires sont apportés à prix particulièrement démocratiques (maximum 1, 70 USD) ou alors gratuitement aux populations des zones d'endémie. Ces moustiquaires sont efficaces pendant 3 à 5 ans selon le modèle et les conditions d'utilisation ;
- installation de grillage moustiquaire aux fenêtres ;
- utilisation d'insecticides à petite échelle : pulvérisation d'insecticides intradomicilaires (pyréthrinoïdes, DDT, ... ) dans les habitations (chambres à coucher) ;
- installation d'air conditionné dans les habitations pour faire baisser la température et brasser l'air (le moustique a horreur des déplacements d'air qui le perturbent dans ses déplacements et dans sa faculté sensorielle à trouver sa cible) ;
- après le coucher du soleil : port de vêtements amples, longs et de couleur claire et abstinence d'alcool (les anophèles sont autant attirés par les couleurs foncées, plus particulièrement le noir, que par les vapeurs d'alcool) ;
- application de crème répulsive sur la peau ou les vêtements dès le coucher du soleil. De l'ensemble des répulsifs de synthèse, ceux qui contiennent du DEET (N, N-diethyl-m-toluamide) sont les plus efficients. Le DEET ne tue pas les insectes mais ses vapeurs les découragent de se poser ou de grimper sur la personne.
Généralement, les produits concentrés entre 25 et 30 % de DEET sont les plus efficaces sur la plus longue période (± 8 h contre les insectes rampants et de 3 à 5 h contre les anophèles). Ils sont aussi reconnus comme inoffensifs pour des personnes adultes ou des enfants de plus de 2 ans si la concentration ne dépasse pas 10 % pour ces derniers. À proscrire chez la femme enceinte et le nourrisson de moins de 3 mois. Les produits concentrés à plus de 30 % ne sont plus homologués.
Les produits commercialisés sont à appliquer à même la peau ou sur les vêtements ou les moustiquaires. Attention cependant à ce qu'ils altèrent les matières plastiques, certains tissus synthétiques comme le nylon, le caoutchouc, le cuir et les surfaces peintes ou vernies. Prendre aussi attention aux yeux ainsi qu'à l'inhalation directe avec les produits en atomiseur ainsi qu'à l'ingestion. Les applicateurs pourvus d'une bille seront par conséquent préférés.
La résorption transcutanée est de 50 % en 6 h et l'élimination sera urinaire. La partie non éliminée (30 %) sera stockée dans la peau et les graisses.
Les répulsifs
Les études ont montré que les produits répulsifs à base d'eucalyptus qui contiennent de l'huile naturelle d'eucalyptol sont une alternative efficace et non-toxique au DEET. En outre, les plantes telles que la citronelle ont prouvé leur efficacité contre les moustiques. Une étude ethnobotanique[103] conduite dans la région du Kilimandjaro (Tanzanie) montre que les répulsifs les plus largementutilisés, par les populations locales, sont des lamiacées du genre ocimée l'Ocimum kilimandscharicum et l'Ocimum suave. L'étude portant sur l'utilisation d'huiles principales extraites de ces ocimées montre que la protection vis-à-vis des piqûres de certains anophèles vecteurs du paludisme augmente dans 83 à 91 % des cas et inhibe, chez l'insecte, son envie de succion dans 71, 2 à 92, 5 % des cas.
L'icaridin aussi connu sous le nom de KBR 3023 est un nouveau répulsif de la famille chimique des pipéridines et de force identique au DEET, mais il est moins irritant et ne dissout pas les plastiques. Il a été développé par la société chimique allemande Bayer AG et commercialisé sous le nom de SALTIDIN®[104]. La forme en gel avec 20 % de produit actif est aujourd'hui la meilleure. Attention, malgré tout, l'ensemble des effets secondaires envisageables vis-à-vis des enfants ne sont pas encore tous connus.
Un essai de divers répulsifs, lancés sur le marché, par une organisation indépendante du consommateur a constaté que les produits répulsifs synthétiques, y compris DEET, étaient plus efficaces que des produits répulsifs avec les substances actives de naturelles.
- utilisation de perméthrine ( (3-phenoxyphenyl) methyl) ou de dérivés de pyréthrinoïde. Ce sont des révulsifs mais peuvent aussi être classés parmi les insecticides. S'ils repoussent et irritent le moustique, ils créent, sur ce dernier, une action de choc (Knock Down) qui le tue ou le neutralise directement.
Ne pas utiliser directement sur la peau mais imprégner les vêtements ou les moustiquaires en prenant garde de ne pas irriter les muqueuses nasales ni d'en ingérer lors de la manipulation. La durée d'efficacité est d'environs 6 mois (moins sur les vêtements qui subissent frottements, pluie, etc…). La réimprégnation se fait après lavage au savon.
Précaution : Ne pas porter des vêtements imprégnés de perméthrine sur la peau déjà traitée au DEET.
Femmes enceintes
Le dernier moyen mis en application est bien plus ciblé. En effet il ne s'applique qu'aux femmes enceintes, et il a pour but d'éviter une grossesse émaillée de problèmes dus à des contractions prématurées et de permettre aux nourrissons de naître en bonne santé et non avec un poids trop faible (en particulier s'il s'agit d'un primipare) ou encore atteint de nombreuses maladies comme le paludisme placentaire (l'infection congénitale, ou non, est en relation directe avec le nombre de parasites dans le placenta), l'anémie grave et la malformation du bébé.
Pour prévenir et d'empêcher de graves complications, une prise en charge globale qui comporte une prévention de l'infection palustre et la protection sanitaire a été mise en place. Ces actions ont pour but de limiter les infections et leurs conséquences pouvant être particulièrement graves pour l'enfant et pour la mère. Il s'agit surtout du recours aux moustiquaires imprégnées d'insecticide et de l'utilisation d'antipaludéens, soit à titre prophylactique primaire, soit comme traitement intermittent. L'administration aux femmes enceintes de quantités supérieures à la normale journalière de multivitamines (B, C et E) mais aussi du fer et de l'acide folique (selon l'OMS, l'UNICEF et selon les recherches de l'université Johns-Hopkins) pourrait former une protection efficace[105]. Une étude auparavant menée montre que la vitamine A serait néfaste et que le zinc n'apporte aucun bénéfice hormis qu'il aide à éviter les diarrhées.
Par contre, il a été, non seulement, prouvé que le traitement intermittent des femmes enceintes par l'association médicamenteuse de SP (sulphadoxine-pyriméthamine) une fois au cours du deuxième trimestre et une seconde fois au cours du troisième trimestre réduisait le risque d'anémie chez la mère, de parasitémie placentaire et d'insuffisance pondérale à l'apparition mais également que le traitement systématique par la SP des nourrissons aux âges de 2, 3 et 9 mois, lors des vaccinations, réduisait de 60 % les épisodes de paludisme clinique et de 50 % les épisodes d'anémie pernicieuse.
Il a été prouvé que dans les zones d'endémies, une prévention efficace du paludisme au cours de la grossesse sert à diminuer l'incidence d'anomalies comme un faible poids à l'apparition ou une anémie maternelle grave (diminution de la concentration en hémoglobine du sang - en dessous de 0, 13 g/ml chez l'homme et de 0, 12 g/ml chez la femme).
L'application de ces quelques règles suffirait à faire baisser énormément le nombre de personnes touchées par cette maladie et ainsi le nombre de victimes, mais le manque de moyens entrave leur application. De nombreux habitants n'ont même pas les moyens de se procurer des moustiquaires, susceptibles de diminuer les risques d'infections.
La prophylaxie
Pour prévenir toute contamination chez les touristes se rendant dans des pays où sévit le paludisme, les chercheurs ont mis en place une technique prophylactique. Cette technique consiste à utiliser un arsenal thérapeutique de médicaments préventifs (se limitant à la chloroquine, au proguanil, à l'association pyrimethamine-dapsone, à l'association proguanil-atovaquone, à l'association chloroquine-proguanil chlorhydrate, à la méfloquine et la doxycycline) afin d'éviter l'infection en cas de pénétration du parasite dans l'organisme.
Il est particulièrement dangereux de partir en zone de transmission intense de paludisme sans prise régulière d'un traitement préventif, surtout pour les enfants et les femmes enceintes qui ont un risque accru d'accès de paludisme grave.
Mais à cause de l'accroissement de la pharmacorésistance parasitaire (résistance des parasites aux produits constituant l'arsenal thérapeutique) et des effets secondaires propres aux divers produits, il est de plus en plus complexe d'établir des directives chimioprophylactiques (recherche de médicament de façon rationnelle). Le touriste doit, avant de s'aventurer dans des pays touchés par ce fléau, consulter son médecin généraliste ou le médecin d'un centre de médecine du voyage qui lui indiquera les contre-indications éventuelles des antipaludéens. Et pour qu'il n'y ait aucune disparité, il serait souhaitable de voir apparaître une harmonisation des directives chimioprophylactiques nationales et mondiales.
Les médicaments antipaludéens ne garantissent pas une protection absolue contre l'infection et il est aussi important de se protéger des piqûres de moustiques (moustiquaires, produits antimoustiques) car même si un traitement adapté a été correctement suivi, il est envisageable de faire une crise de paludisme, quelquefois d'apparition tardive à cause de la forme hypnozoïte que peut prendre le Plasmodium.
Selon un rapport français du Centre national de référence pour l'épidémiologie du paludisme d'importation et autochtone, fondé sur une étude auprès des 8 000 Français ayant contracté la maladie en l'an 2000, près de la moitié n'avait eu recours à aucune prophylaxie.
En 2002, seuls 10 % des voyageurs français en déplacement dans une zone à risque ont suivi un schéma thérapeutique correct. En 1990, ce pourcentage était d'un tiers : cela explique, en partie, la forte recrudescence des cas de paludisme en France, cas atypique en Europe, où la contamination est stable ou en régression.
En Belgique, des cas de décès dus à la malaria surviennent, chaque année, chez les voyageurs de retour au pays[106].
Schémas prophylactiques antipaludéens
Au 9 mars 2006, la prévention du risque paludéen s'organise en trois niveaux, classés selon le niveau de chimio-résistance. Chaque pays à risque se trouvant ainsi classé dans un groupe. Bien avant de partir en voyage, il convient de demander l'avis de son médecin car ces traitements sont le plus souvent à commencer à l'avance.
- Pays du groupe 0
- Zones sans paludisme : Pas de chimioprophylaxie.
-
- Afrique : le Lesotho, la Libye, le Maroc, La Réunion, l'île Sainte-Hélène, les Seychelles et la Tunisie ;
- Amérique : l'ensemble des villes, Antigua-et-Barbuda, les Antilles néerlandaises, les Bahamas, la Barbade, les Bermudes, le Canada, le Chili, Cuba, la Dominique, les États-Unis, la Grenade, les îles Caïmans, les îles Malouines, les îles Vierges, la Jamaïque, la Martinique, Porto Rico, Sainte-Lucie, la Trinité-et-Tobago et l'Uruguay ;
- Asie : l'ensemble des villes, Brunei, la Géorgie, Guam, Hong Kong, l'île Christmas, les îles Cook, le Japon, le Kazakhstan, le Kirghizistan, Macao, les Maldives, la Mongolie, Singapour et Taïwan ;
- Europe : l'ensemble des pays y compris les Açores, les Canaries, Chypre, la Russie, les pays baltes, l'Ukraine, la Biélorussie et la Turquie d'Europe ;
- Proche et Moyen-Orient : l'ensemble des villes, Bahreïn, Israël, la Jordanie, Koweït, le Liban et le Qatar ;
- Océanie : l'ensemble des villes, l'Australie, les Fidji, Hawaii, les îles Mariannes, les Marshall, la Micronésie, la Nouvelle-Calédonie, la Nouvelle-Zélande, l'île de Pâques, la Polynésie française, les Samoa, les Tonga et les Tuvalu.
- Cas spécifique des zones de transmission faible
- Compte tenu de la faiblesse de la transmission dans ces pays, il est acceptable de ne pas prendre de chimioprophylaxie quelle que soit la durée du séjour. Il est cependant indispensable d'être en mesure, dans les mois qui suivent le retour, de consulter en urgence en cas de fièvre.
-
- Afrique : l'Algérie, le Cap-Vert, l'Égypte et Maurice ;
- Asie : l'Arménie, l'Azerbaïdjan, la Corée du Nord, la Corée du Sud, l'Ouzbékistan et le Turkménistan ;
- Proche et Moyen-Orient : les Émirats arabes unis, Oman, la Syrie et la Turquie.
- Pour l'ensemble des autres pays, il est indispensable de prendre une chimioprophylaxie adaptée à la zone visitée.
- Pays du groupe 1
- Zones sans chloroquinorésistance : chloroquine 100 mg : un comprimé chaque jour (il est envisageable aussi de prendre 300 mg. deux fois par semaine) pour une personne pesant au moins 50 kg (à utiliser avec prudence chez les épileptiques et , chez tout un chacun, car pouvant provoquer des troubles de la vue ou alors la cécité avec des prises de trop longue durée).
- Pays du groupe 2
- Zones de chloroquinorésistance : chloroquine 100 mg, (un comprimé chaque jour) et proguanil 100 mg, (deux comprimés chaque jour).
- L'association chloroquine-proguanil, sera ingérée, au cours d'un repas, en une prise ou par demi dose matin et soir en débutant 1 semaine avant le départ et jusqu'à 1 mois après le retour pour une personne pesant au moins 50 kg (pour une personne de moins de 50 kg, se référer au chapitre sur l'enfant voyageur).
- L'association atovaquone-proguanil peut être conseillée en alternative à l'association chloroquine-proguanil (voir le paragraphe "Pays du groupe 3" pour plus de détail sur l'association atovaquone-proguanil).
- Pays du groupe 3
- Zones de prévalence élevée de chloroquinorésistance ou multirésistance[107]
La doxycycline[108] (principe actif)
- 1 comprimé de 100 mg. par jour, 1 jour avant le départ (prise doublée le 1er jour) et jusqu'à 28 jours après le retour ou après avoir quitté la zone d'endémie de malaria (à prendre en position assise avec une grande quantité de liquide ou au cours du repas). Les doses sont à divisés par deux pour les enfants de plus de huit ans.
- La doxycycline peut être prise pendant plusieurs mois mais peut provoquer une phototoxicité (réaction chimique génèrée par la présence trop grande de substance photoréactive dans la peau et réagissant sous l'effet des rayons UV ou visibles) et des mycoses buccales et génitales ; elle est à proscrire aux femmes enceintes (troubles hépatiques) ou allaitantes mais aussi chez les enfants de moins de 8 ans (ralentissement réversible de la croissance osseuse et coloration jaune irréversible des dents avec un risque accru de caries)
- Il s'agit d'un dérivé de la tétracycline (antibiotique à 4 cycles accolés capable de pénétrer les cellules eucaryotes dont font partie le Plasmodium) quelquefois utilisé contre le paludisme en association avec la quinine pour des traitements d'urgence par voie intraveineuse.
La méfloquine comme le LARIAM®[109] (Roche)
- Composition : 250 mg. méfloquine
Boite de 8 comprimés - 34, 26 EUR (Prix en Belgique en 2009)
- 1 comprimé par semaine, quelques semaines avant le départ et jusqu'à 4 semaines après le retour
- Pour obtenir une concentration dans le sang efficace de LARIAM® dès l'arrivée, il est indispensable d'initier le traitement 2 à 3 semaines avant le départ. Les personnes qui n'ont jamais pris ce produit jusque là doivent débuter le traitement 2-3 semaines avant le départ, pour déceler d'éventuels effets secondaires (vertige, insomnie, cauchemar, excitation, angoisse inexplicable, palpitations). Il ne sera pas prescrit si le médecin juge qu'il existe une contre-indication (souhait de grossesse, premier trimestre de grossesse, épilepsie, dépression, ou troubles du rythme pour lesquels un traitement est en cours avec des médicaments tels que des bêta-bloquants, des antagonistes calciques, ou de la digitaline), ou s'il n'a pas été supporté dans le passé. Il faut poursuivre le traitement jusqu'à 4 semaines après le retour. Si le LARIAM® est bien supporté, il peut être pris pendant des mois ou alors des années si indispensable.
- Pour les séjours prolongés (durée supérieure à 3 mois), la chimioprophylaxie doit être maintenue aussi longtemps que envisageable et il est recommandé aux voyageurs de prendre rapidement contact avec un médecin sur place pour évaluer la pertinence et le rapport bénéfice/risque de la chimioprophylaxie.
L'association atovaquone-proguanil comme le MALARONE®[110] (GlaxoSmithKline) peut être conseillée en alternative à la méfloquine.
- Composition pour adulte : 250 mg. atovaquone + 100 mg. proguanil chlorhydrate
Boite de 12 comprimés - 43, 31 EUR (prix en Belgique en 2009)
- Composition pour junior : 62, 5 mg. atovaquone + 25 mg. proguanil chlorhydrate
Boite de 12 comprimés - 18, 48 EUR (prix en Belgique en 2009)
- 1 comprimé par jour, 1 jour avant le départ et jusqu'à 7 jours après le retour.
- Si la première prise ne commence que durant le séjour, il convient de le prendre jusqu'à 4 semaines après le retour.
- Pour un voyage de courte durée, la prise de MALARONE®, généralement particulièrement bien toléré, est un excellent choix. Elle est parfois utilisée pendant plusieurs mois (mais il faudra alors prendre en compte son coût élevé). La durée d'administration continue de l'atovaquone-proguanil dans cette indication devra, cependant, être limitée à 3 mois, faute de disposer à ce jour d'un recul suffisant en traitement prolongé.
En tout état de cause, l'avis d'un médecin est plus que souhaitable avant toute médication.
L'avenir
Les recherches tant en pharmacologie pour les traitements (voir la section «Le futur - La pharmacologie») qu'en vaccination pour la prophylaxie (Voir le sous titre «Le futur - Les vaccins») vont à un rythme de plus en plus accéléré grâce à des sponsors comme le Malaria Vaccine Initiative ou des ONG comme MSF.
Les précautions à prendre
La prise de médicaments antipaludéens, même en respectant un schéma thérapeutique correct, ne suffit pas à protéger à 100 % contre le risque de paludisme. Il faut aussi se protéger des moustiques, les empêcher de rentrer en contact avec leurs victimes, afin d'éviter la piqûre de l'insecte.
- Éviter les déplacements en zone à risque sans protection, toujours dormir avec une moustiquaire dont les mailles sont inférieures à 1, 5 mm, même à la belle étoile ;
- Porter des vêtements longs, amples et de couleur claire, serrés aux poignets ainsi qu'aux chevilles, avec des chaussures fermées, imprégnées de répulsif (attention, le moustique anophèle vole fréquemment au raz du sol et peut piquer à travers les chaussettes) ;
- Appliquer des répulsifs cutanés sur l'ensemble des parties non couvertes du corps (à base de DEET mais à éviter pour les nourrissons de moins de 3 mois et les femmes enceintes ou allaitantes) ;
- Utiliser des insecticides, à l'intérieur, ainsi qu'à l'extérieur ;
- Dormir avec l'air conditionné ou sous une moustiquaire (de prédilection imprégné d'insecticide quand le corps, la nuit, peut être en contact avec cette moustiquaire) : l'homme agit ainsi comme un appat et outre la barrière mécanique de la moustiquaire empêchant la piqûre, elle provoque la mort du moustique qui est entré au contact de l'insecticide.
- Protéger l'ensemble des ouvertures par des moustiquaires appropriées.
L'utilisation de produits répulsifs ou anti-insectes (tels le DEET ou le DDT) et de moustiquaires diminué les risques d'infection, mais une chimioprophylaxie reste indispensable (Nivaquine, Savarine, LARIAM®, MALARONE®). Il est déconseillé de boire de l'alcool en ayant pris ces médicaments.
Conséquences économiques
Selon la Ligue contre le paludisme, une famille touchée ne récolterait que 40 % de sa production agricole, du fait des journées de travail perdues. L'OMS a même calculé que le PIB africain dépasserait de 115 milliards d'euros son niveau actuel, soit 32 % supplémentaires, si on avait éliminé le paludisme il y a 35 ans.
Sur le plan de la lutte, l'UNICEF estime que le coût moyen annuel des programmes antipaludéens dans chaque pays d'Afrique se monterait à à peu près 345 000 euros, soit, pour un pays de 5 millions d'habitants, moins de sept centimes d'euros par habitant.
Les populations situées dans des zones impaludées vivant dans leur immense majorité dans la pauvreté, les nouveaux médicaments, nettement plus efficaces mais plus coûteux que les anciens, sont fréquemment au-delà de leurs moyens.
Il arrive même quelquefois qu'un patient ne suive pas entièrement son traitement et , se sentant guéri, qu'il aille vendre ce qui lui reste au marché noir, accélérant ainsi la naissance de résistances aux traitements (voir chapitre sur la résistance du parasite).
D'après les chiffres, le secteur privé consacrait, en 1990 et par victime, 789 dollars pour combattre l'asthme, 3 274 pour le sida (dont le virus concerne tout autant les pays en voie de développement que les pays développés) et uniquement 65 dollars en ce qui concerne le paludisme. C'est à dire, la somme consacrée à la recherche de vaccins et au développement de médicaments antipaludéens est ridicule quand on sait que près de 50 % de la population mondiale est menacée.
De plus, la grande majorité des pays touchés par la malaria n'ont ni les moyens économiques ni les moyens technologiques de développer dans leur pays une réelle recherche dans le domaine médical. Des pays aux moyens financiers particulièrement limités (le plus fréquemment croulant sous le poids de la dette extérieure), un manque de solide volonté politique, un budget recherche bien inférieur aux attentes et une aide mondiale dérisoire comparée aux besoins des populations et au nombre de personnes touchées, rappellent que les conséquences aussi désastreuses de cette maladie du sous-développement ne sont pas entièrement dues à la nature, que l'être humain y est pour énormément.
Cependant l'OMS a fondé en 2001 un Fond mondial pour lutter contre la malaria mais également contre le SIDA et la tuberculose.
Depuis 2003, la fondation Bill-et-Melinda-Gates (Bill & Melinda Gates Foundation), a aussi versé plusieurs centaines de millions de dollars, entre autres à la Malaria Vaccine Initiative, pour lutter contre la maladie.
Créé en 2002, le Fonds mondial de lutte contre le SIDA, la tuberculose et le paludisme, ou Fonds mondial, regroupe des financements internationaux en faveur du traitement du paludisme.
Divers
- En France, cette maladie est sur la liste des Maladies infectieuses à déclaration obligatoire.
- Le paludisme a été fréquemment illustré sur des timbres. Le premier exemple est un timbre de bienfaisance du Mexique émis en 1939 qui montre un être humain victime d'un moustique géant. Mais le plus spectaculaire fut l'émission de 1962 simultanée dans une centaine de pays célébrant la campagne de l'OMS intitulée éradication du paludisme. L'OMS a fait de l'éradication du paludisme l'une de ses principales priorités.
- Le roman Le Chromosome de Calcutta d'Amitav Ghosh (éd. Seuil 1998, coll. Cadre vert [1]) fait une large place au récit, dans une atmosphère fantastique, de la découverte de Ronald Ross sur le paludisme.
Annexes
Bibliographie
- Jacques Verdrager, L'OMS et le paludisme : mémoires d'un médecin spécialiste de la malaria. – L'Harmattan, coll. «Acteurs de la science», Paris, 2005 (ISBN 2-7475-8246-9)
- «Santé des voyageurs et recommandations sanitaires 2005», Bulletin épidémiologique hebdomadaire, no 24-25/2005 (14 juin 2005) [lire en ligne]
- Robert W. Snow et al. «The global distribution of clinical episodes of Plasmodium falciparum malaria», Nature, vol. 434, n° 7030 (10 mars 2005), pp. 214-217 [ (en) présentation en ligne]
- Marie Josserand Debacker, Paludisme : historique, mythes, croyances et idées reçues, thèse d'exercice, Médecine, Paris XII, 2000 [lire en ligne]
- Serge Paul Eholié, Emmanuel Bissagnéné et Pierre-Marie Girard (dir. ), Mémento thérapeutique du paludisme en Afrique, Doin, IMEA, Paris, 2008, 139 p. (ISBN 978-2-7040-1253-4)
- Christian Lengeler, Jacqueline Cattani et Don de Savigny (dir. ), Un mur contre la malaria : du nouveau dans la prévention des décès dus au paludisme, Centre de recherches pour le développement mondial, Ottawa ; Organisation mondiale de la santé, Genève, 1997, 220 p. (ISBN 0-88936-831-7)
- Jean Mouchet, Pierre Carnevale, Marc Coosemans et al., Biodiversité du paludisme dans le monde, J. Libbey Eurotext, Montrouge, 2004, 428 p. (ISBN 2-74200-528-5)
Filmographie
- Paludisme, l'hécatombe silencieuse, documentaire réalisé par Bernard Germain et Jean Vercoutère, produit par Mosaïque Films (Paris) et distribué par ADAV, 2000, 54' (VHS)
Notes et références
- (en) Cet article est partiellement ou en totalité issu d'une traduction de l'article de Wikipédia en anglais intitulé «Malaria».
- ↑ (fr) Définitions lexicographiques et étymologiques de paludisme du CNRTL.
- ↑ (fr) Définitions lexicographiques et étymologiques de malaria du CNRTL.
- ↑ Joy D, Feng X, Mu J, et al, «Early origin and recent expansion of Plasmodium falciparum», dans Science, vol. 300, issue 5617, pp. 318-21, 2003.
- ↑ Escalante A, Freeland D, Collins W, Lal A, «The evolution of primate malaria parasites based on the gene encoding cytochrome b from the linear mitochondrial genome», Proc Natl Acad Sci U S A, vol. 95, issue 14, pp. 8124-9, 1998 [lire en ligne].
- ↑ F. Cox, «History of human parasitology», dans Clin Microbiol Rev, vol. 15, n°4, pp. 595-612, 2001 [lire en ligne].
- ↑ Kaufman T, Rúveda E, «The quest for quinine : those who won the battles and those who won the war», dans Angew Chem Int Ed Engl, vol. 44, n°6, pp. 854-85, 2005.
- ↑ Kyle R, Shampe M, «Discoverers of quinine», dans JAMA, vol. 229, n°4, p. 462, 1974.
- ↑ Biography of Alphonse Laveran, The Nobel Foundation [lire en ligne].
- ↑ Page sur Ettore Marchiafava.
- ↑ Lénaick Ollivier de l'Institut de médecine tropicale du service de santé des armées (IMTSSA Marseille), cité par Le Figaro du 10 juin 2008, page 16.
- ↑ Biography of Ronald Ross, The Nobel Foundation [lire en ligne].
- ↑ Ross and the Discovery that Mosquitœs Transmit Malaria Parasites
- ↑ Raju T, «Hot brains : manipulating body heat to save the brain», dans Pediatrics, vol. 177, n°2, p. e320-1, 2006 [lire en ligne].
- ↑ CHLOROQUINE DIPHOSPHATE[lire en ligne]
- ↑ Anthony Sutton, Wall Street and the Rise of Hitler, chap. 2 «The Empire of I. G. Farben», The Modern History Project, 1976 [lire en ligne].
- ↑ Hempelmann E., «Hemozoin biocrystallization in Plasmodium falciparum and the antimalarial activity of crystallization inhibitors», dans Parasitol Research, vol. 100, n°4, pp. 671-676, 2007.
- ↑ Linus Pauling, Harvey Itano, S. J. Singer et Ibert Wells, «Sickle Cell Anemia, a Molecular Disease», dans Science, novembre 1949 [lire en ligne].
- ↑ Trager & Jensen, «Human malaria parasites in continuous culture», dans Science, vol. 193, n°4254, pp. 673-5, août 1976.
- ↑ Krotoski W, Collins W, Bray R, et al, «Demonstration of hypnozoites in sporozoite-transmitted Plasmodium vivax infection», dans Am J Trop Med Hyg, vol. 31, n°6, pp. 1291-3, 1982. Voir aussi Meis J, Verhave J, Jap P, Sinden R, Meuwissen J, «Malaria parasites -- discovery of the early liver form», dans Nature, vol. 302, n°5907, pp. 424-6, 1983.
- ↑ L'article du Microbe Magazine de septembre 2009 sur le potentiel antipaludique de l'algue rouge[ (en) lire en ligne]
- ↑ Cochrane Reviews publié le 19 avril 2006 [ (en) lire en ligne]
- ↑ Fact Sheet : RTS, S Malaria Vaccine Clinical Trials. Dossier de presse du 17 octobre 2007 émis conjointement par The PATH Malaria Vaccine Initiative (PATH/MVI) et GlaxoSmithKline Biologicals (GSK Bio) [ (fr) lire en ligne]
- ↑ Informations données par le Professeur Alonso sur le RTS, S dans le The Lancet du 10 décembre 2005[ (en) lire en ligne]
- ↑ Malaria Vaccine Initiative - Sites choisis pour les essais cliniques de la phase III du RTS, S/AS02A[ (en) lire en ligne]
- ↑ Articlede la revue scientifique Plos One du 2 octobre 2009 sur le PfCS102/AS02A[ (en) lire en ligne]
- ↑ Communiqué de presse de l'Institut Pasteur[ (fr) lire en ligne]
- ↑ Institute of Medicine -Rapport du 25 mai 2006 - Battling Malaria : Strengthening the U. S. Military Malaria Vaccine Program[ (en) lire en ligne]
- ↑ Curriculum vitæ du Professeur Crisanti[ (en) lire en ligne]
- ↑ Science Daily du 21 février 2003[ (en) lire en ligne]
- J. Breman, «The ears of the hippopotamus : manifestations, determinants, and estimates of the malaria burden», dans Am J Trop Med Hyg, vol. 64, n°1-2, pp. 1-11, 2001 [lire en ligne].
- ↑ L'estimation est complexe du fait du manque de fiabilité des statistiques dans les pays concernés ; en 2005, des chercheurs estimaient dans la revue Nature à 515 millions le nombre de malades en 2002 (dans une fourchette allant de 300 à 660 millions), tandis que l'estimation de l'OMS en 1999 dans son rapport sur la santé dans le monde était de 273 millions. L'OMS a déclaré avoir révisé ce chiffre dès l'année suivante et travailler depuis avec une fourchette allant de 300 à 500 millions. Cf. la dépêche de John Bonner du 10 mars 2005 (15 :18), «Row erupts over WHO's malaria'miscalculation'», sur le site du New Scientist [ (en) lire en ligne]
- Greenwood BM, Bojang K, Whitty CJ, Targett GA, «Malaria», dans Lancet, vol. 365, p. 1487-1498, 2005.
- ↑ Hay S, Guerra C, Tatem A, Noor A, Snow R, «The global distribution and population at risk of malaria : past, present, and future», dans Lancet Infect Dis, vol. 4, n°6, pp. 327-36, 2004.
- ↑ Korenromp E, Williams B, de Vlas S, Gouws E, Gilks C, Ghys P, Nahlen B, «Malaria attributable to the HIV-1 epidemic, sub-Saharan Africa», dans Emerg Infect Dis, vol. 11, n°9, pp. 1410-9, 2005 [lire en ligne]
- ↑ Abu-Raddad L, Patnaik P, Kublin J, «Dual infection with HIV and malaria fuels the spread of both diseases in sub-Saharan Africa», dans Science, vol. 314, n°5805, pp. 1603-6, 2006.
- ↑ Layne SP, Principles of Infectious Disease Epidemiology, EPI 220, UCLA Department of Epidemiology [lire en ligne]
- ↑ Greenwood B, Mutabingwa T, «Malaria in 2002», dans Nature, vol. 415, n°670-2, 2002.
- ↑ Grover-Kopec E, Kawano M, Klaver R, Blumenthal B, Ceccato P, Connor S, «An online operational rainfall-monitoring resource for epidemic malaria early warning systems in Africa», dans Malar J. , vol. 4, p. 6, 2005 [lire en ligne]
- ↑ Van Benthem B, Vanwambeke S, Khantikul N, Burghoorn-Maas C, Panart K, Oskam L, Lambin E, Somboon P, «Spatial patterns of and risk factors for seropositivity for dengue infection», dans Am J Trop Med Hyg, vol. 72, n°2, pp. 201-8, 2005 [lire en ligne]
- ↑ Trung H, Van Bortel W, Sochantha T, Keokenchanh K, Quang N, Cong L, Coosemans M, «Malaria transmission and major malaria vectors in different geographical areas of Southeast Asia», dans Trop Med Int Health, vol. 9, n°2, pp. 230-7, 2004.
- ↑ Keiser J, Utzinger J, Caldas de Castro M, Smith T, Tanner M, Singer B, «Urbanization in sub-saharan Africa and implication for malaria control», dans Am J Trop Med Hyg, vol. 71, n°2, pp. 118-27, 2004 [lire en ligne]
- ↑ Hay SI, Snow RW, «The Malaria Atlas Project : Developing Global Maps of Malaria Risk», dans PLoS Medicine, vol. 3, n°12, p. e473, 2006 [lire en ligne]
- ↑ Simon I. Hay et al. , «The global distribution and population at risk of malaria : past, present, and future», in The Lancet Infectious Diseases, vol. 4, n° 6, juin 2004, p. 327-336 [ (en) lire en ligne]
- ↑ Le Figaro du 10 juin 2008, page 16
- ↑ (en) The American Journal of Tropical Medecine & Hygiene - POPULATION GENETIC STRUCTURE OF THE AFRICAN MALARIA MOSQUITO ANOPHELES FUNESTUS IN KENYA - 2003 [lire en ligne]
- ↑ Sachs J, Malaney P, «The economic and social burden of malaria», dans Nature, vol. 415, p. 680-5, 2002.
- ↑ Article du The Seattle Times du 13 juin 2008 - «Rétablir les solutions de basse technologie» [ (en) lire en ligne]
- ↑ Roll Back Malaria, Economic costs of malaria, OMS [lire en ligne]
- ↑ Mendis K, Sina B, Marchesini P, Carter R, «The neglected burden of Plasmodium vivax malaria», dans Am J Trop Med, vol. 64, n°1-2, pp. 97-106, 2001 [lire en ligne].
- ↑ Escalante A, Ayala F, «Phylogeny of the malarial genus Plasmodium, derived from rRNA gene sequences», dans Proc Natl Acad Sci U S A, vol. 91, n° 24, pp. 11373-7, 1994.
- ↑ PCC Garnham, Malaria parasites and other hæmosporidia, Blackwell Scientific Publications, Oxford, 1996.
- ↑ Permin A. et Madsen M., Investing in Animal Health Research to Alleviate Poverty, Mondial Livestock Research Institute, 2001, Appendix 2 : review on disease occurrence and impact (smallholder poultry) [lire en ligne].
- ↑ Atkinson CT, Woods KL, Dusek RJ, Sileo LS, Iko WM, «Wildlife disease and conservation in Hawaii : pathogenicity of avian malaria (Plasmodium relictum) in experimentally infected iiwi (Vestiaria coccinea)», dans Parasitology, vol. 111 Suppl, pp. S59-69, 1995.
- ↑ Talman A, Domarle O, McKenzie F, Ariey F, Robert V, «Gametocytogenesis : the puberty of Plasmodium falciparum», dans Malar J, vol. 3, p. 24.
- ↑ Entomologie du paludisme et contrôle des vecteurs; Trans. du paludisme (pages 7 et 8) -OMS 2003[lire en ligne]
- ↑ MEDECINE/SCIENCES 2005 (Trafic protéique dans le globule rouge infecté par Plasmodium) [lire en ligne]
- ↑ Université Paris Val de Marne - 2000 - Thèse pour le diplôme d'État de docteur en médecine (Titre 1.2.2. ) [lire en ligne]
- ↑ Marcucci C, Madjdpour C, Spahn D, «Allogeneic blood transfusions : benefit, risks and clinical indications in countries with a low or high human development index», dans Br Med Bull, vol. 70, pp. 15-28.
- ↑ Malaria life cycle & pathogenesis. Malaria in Armenia.
- Trampuz A, Jereb M, Muzlovic I, Prabhu R, «Clinical review : Severe malaria», dans Crit Care, vol. 7, n°4, pp. 315-23, 2003 [lire en ligne]
- ↑ Kain K, Harrington M, Tennyson S, Keystone J, «Imported malaria : prospective analysis of problems in diagnosis and management», dans Clin Infect Dis, vol. 27, n°1, pp. 142-9, 1998.
- ↑ R. Idro et al., «Decorticate, decerebrate and opisthotonic posturing and seizures in Kenyan children with cerebral malaria», dans Malaria Journa, vol. 4, n°57 [lire en ligne]
- ↑ M. J. Boivin, «Effects of early cerebral malaria on cognitive ability in Senegalese children», dans Journal of Developmental and Behavioral Pediatrics, vol. 23, n°5, oct. 2002 : p353-64 [lire en ligne]
- ↑ Holding, P. A. et Snow, R. W., «Impact of Plasmodium falciparum malaria on performance and learning : review of the evidence», dans American Journal of Tropical Medicine and Hygiene, vol. 64, n°1-2, janv. -fév. 2001 : p68-75 [lire en ligne]
- ↑ Carter JA et al., «Developmental impairments following severe falciparum malaria in children», dans Trop Med Int Health, vol. 10, pp. 3-10, 2005.
- ↑ Redd S et al., «Clinical algorithm for treatment of Plasmodium falciparum malaria in children», dans Lancet, vol. 347, n°8996, pp. 223-7, 1996.
- ↑ Les «Community Health Worker» ou «CHW» sont des membres de la communauté ayant reçu une formation de base leur servant à prodiguer les soins élémentaires en l'absence de personnel médical professionnel.
- ↑ American Journal of Public Health - Community Health Worker Performance in the Management of Multiple Childhood Illnesses : Siaya District, Kenya, 1997–2001 - octobre 2001 [ (en) lire en ligne]
- ↑ Beare NA et al. Am J Trop Med Hyg. 2006 Nov;75 (5) :790-797.
- ↑ Sanofi Aventis-L'actualité du paludisme destinée aux professionnels-Section 4F2 (Microscopie : Détection des parasites) [lire en ligne]
- ↑ Warhurst DC, Williams JE, «Laboratory diagnosis of malaria», dans J Clin Pathol, vol. 49, pp. 533-38, 1996.
- ↑ Directives pour le traitement du paludisme-annexe 5.2 (page 166) - 2006 [lire en ligne]
- ↑ Pattanasin S et al., «Evaluation of a new Plasmodium lactate dehydrogenase assay (OptiMAL-IT®) for the detection of malaria», dans Transact Royal Soc Trop Med, vol. 97, pp. 672-4, 2003.
- ↑ RollBackMalaria - Consommables et produits non médicaux pour le paludisme - Séminaire du 5 au 9 mars 2006 à Dakar[lire en ligne]
- ↑ Ling IT. et al., «Antibodies to the glutamate dehydrogenase of Plasmodium falciparum», dans Parasitology, vol. 92, pp. 313-24, 1986
- ↑ Malaria Journal - Operational accuracy and comparative persistent antigenicity of HRP2 rapid diagnostic tests for Plasmodium falciparum malaria in a hyperendemic region of Uganda - 29/10/2008 (en) [lire en ligne]
- ↑ Mens PF, Schoone GJ, Kager PA, Schallig HDFH, «Detection and identification of human Plasmodium species with real-time quantitative nucleic acid sequence-based augmentcation», dans Malaria journal, vol. 5, n° 80, 2006.
- ↑ Adak T, Sharma V, Orlov V, «Studies on the Plasmodium vivax relapse pattern in Delhi, India», dans Am J Trop Med Hyg, vol. 59, n°1, pp. 175-9, 1998
- ↑ NCBI - Taxonomy browser (Navigateur sur les codes génétiques des différences espèces de Plasmodium falciparum) [ (en) lire en ligne]
- ↑ Mockenhaupt F et al., «Manifestation and outcome of severe malaria in children in northern Ghana», dans Am J Trop Med Hyg, vol. 71, n°2, pp. 167-72, 2004.
- ↑ Les médicaments obsolètes retardent la victoire contre le paludisme - Article du Daily Nation du 30/06/2009 [ (en) lire en ligne]
- ↑ Des cliniques privées utilisent toujours les anciens traitements - Article du Daily Nation du 23/04/2009 [ (en) lire en ligne]
- ↑ (en) Malaria — Time to Act, Nicholas J. White, New Eng. J. Med., 9/11/2006, 355 :1956-1957.
- ↑ (en) Return of Chloroquine Antimalarial Efficacy in Malawi, Miriam K. Laufer, Phillip C. Thesing, Nicole D. Eddington, Rhoda Masonga, Fraction K. Dzinjalamala, Shannon L. Takala, Terrie E. Taylor, Christopher V. Plowe, New Engl. J. Med., 9/11/2006;355 :1959-1966.
- ↑ Rev Prescrire 2007;27 (290) :913-920 reprenant World Health Organisation "Guideline for the treatment of malaria" Geneva 2006 :261p
- ↑ (en) Afonso A, Hunt P, Cheesman S, Alves AC, Cunha CV, do Rosário V, 1 and Cravo P, «Malaria parasites can develop stable resistance to artemisinin but lack mutations in candidate genes», dans Antimicrob. Agents Chemother. , vol. 50, no 2, 2006, p. 480-489 [lien PMID lien DOI]
- ↑ L'Asaq : un nouveau médicament. Dossier "Malaria" de MSF Belgique [[id=3&uw_vars[table]=tx_uwazg_theme&cHash=ed97c7781e lire en ligne]]
- ↑ «Malaria parasites resist drugs», BBC NEWS, 29 mai 2009[ (en) lire en ligne]
- ↑ The New England journal of Medicine du 30 juillet 2009 - Artemisinin Resistance in Plasmodium falciparum Malaria[ (en) lire en ligne]
- ↑ Ruttimann J «Halt called on single-drug antimalarial prescriptions», dans Nature News, 20 janvier 2006[ (en) lire en ligne]
- ↑ Rapport 2007 de l'OMS sur les suppositoires à l'artémisinine [lire en ligne]
- ↑ Lon CT, Tsuyuoka R, Phanouvong S, et al. , «Counterfeit and substandard antimalarial drugs in Cambodia», dans Trans R Soc Trop Med Hyg, vol. 100, n°11, pp. 1019-24, 2006.
- ↑ U. S. Pharmacopeia, Fake antimalarials found in Yunan province, China, 2004 [lire en ligne]
- ↑ Newton PN, Green MD, Fernández FM, Day NPJ, White NJ, «Counterfeit anti-infective drugs», dans Lancet Infect Dis, vol. 6, n°9, pp. 602-13, 2006
- ↑ BBC News du 17 août 2007 [lire en ligne]
- ↑ Kevin Hull, Malaria : Fever Wars, documentaire PBS, 2006 [lire en ligne]
- ↑ Barat, «Four malaria success stories : how malaria burden was successfully reduced in Brazil, Eritrea, India, and Vietnam», dans Am J Trop Med Hyg, vol. 74, n°1, pp. 12-16, 2006.
- ↑ OMS-Position sur l'utilisation du DDT 2005 [lire en ligne]
- ↑ Préfecture de la Réunion - Direction des Affaires Sanitaires et Sociales - La lutte contre les moustiques - 2006 [lire en ligne]
- ↑ Organisation mondiale de la santé, La planification de programmes de lutte contre le paludisme : guide du stagiaire, éd. provisoire, OMS, Genève, 2003, p. 128 [lire en ligne]
- ↑ Société Française pour l'Etude et la Protection des Mammifères-Nuit européenne des chauves-souris 2008 [lire en ligne]
- ↑ Eurekalert. org - Le séquençage du génome du moustique, publié dans la revue Science, ouvre la voie à de nouveaux moyens de lutte contre le paludisme - 02/10/2002[lire en ligne]
- ↑ Ethnobotanical study of some of mosquito repellent plants in north-eastern Tanzania - Eliningaya J Kweka, Franklin Mosha, Asanterabi Lowassa, Aneth M Mahande, Jovin Kitau, Johnson Matowo, Michæl J Mahande, Charles P Massenga, Filemoni Tenu, Emmanuel Feston, Ester E Lyatuu, Michæl A Mboya, Rajabu Mndeme, Grace Chuwa and Emmanuel A Temu - Malaria Journal 2008, 7 :152doi :10.1186/1475-2875-7-152 publié le 7 août 2008
- ↑ Saltidin - Informations techniques [ (en) lire en ligne]
- ↑ Johns Hopkins University-Tests de traitement de l'anémie 2003 [lire en ligne]
- ↑ Institut de Médecine Tropicale Anvers-Conseils de santé pour voyageurs;édition destinée au corps médical 2007-2008 [[
- http ://www. itg. be/ITG/Uploads/MedServ/fmedasso. pdf lire en ligne]]
- ↑ ITG (Instituut voor Tropische Geneeskunde-Votre santé durant le voyage-Malaria (version août 2008) [lire en ligne]
- ↑ Centre Belge d'Information Pharmacothérapeutique-Commentaires, posologie des tétracyclines [lire en ligne]
- ↑ Centre Belge d'Information Pharmacothérapeutique-Commentaires, posologie des antipaludéens-Répertoire "nom de la spécialité" débutant par "L" [lire en ligne]
- ↑ Centre Belge d'Information Pharmacothérapeutique-Commentaires, posologie des antipaludéens-Répertoire "nom de la spécialité" débutant par "M" [lire en ligne]
Pour aller plus loin
Liens externes
- (fr) Particulièrement réalisé pour la 2e journée mondiale contre le paludisme, un entretien avec Didier Fontenille, directeur de recherche à l'IRD sert à faire le point sur les recherches en cours sur la maladie, leur variété et leurs objectifs. Il brosse un tableau de l'horizon qui se présente devant les acteurs de la prévention et de la recherche, des difficultés qu'ils font la connaissance de mais également de l'espoir de faire reculer la pandémie.
- (fr) Directives de l'OMS pour le traitement du paludisme
- (fr) Malaria Atlas Project
- (fr) Nouveaux gènes découverts dans le parasite du paludisme (Ambassade de France, Danemark, mai 2008)
- (en) Site de l'European Malaria Vaccine Initiative ; Site de la Malaria Vaccine Initiative
- (en) Le site Web du PATH («Program for Appropriate Technology in Health»)
- (en) Site européen BIOMALPAR, dédié au paludisme;Projets de la Banque mondiale
- (fr) Paludisme ou Malaria
Recherche sur Amazone (livres) : |
Voir la liste des contributeurs.
La version présentée ici à été extraite depuis cette source le 22/11/2009.
Ce texte est disponible sous les termes de la licence de documentation libre GNU (GFDL).
La liste des définitions proposées en tête de page est une sélection parmi les résultats obtenus à l'aide de la commande "define:" de Google.
Cette page fait partie du projet Wikibis.


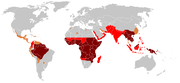

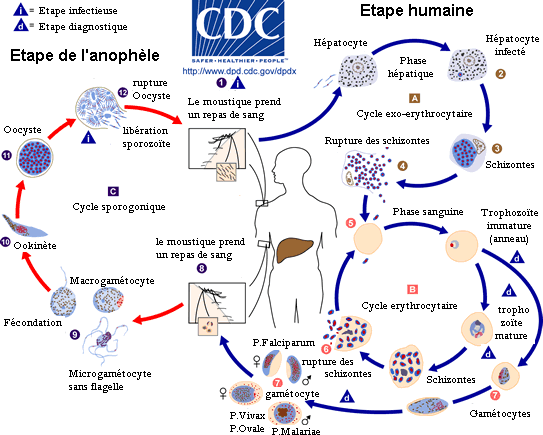
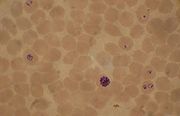
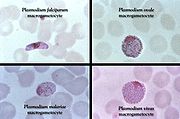
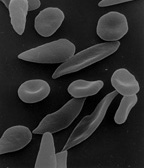


 Accueil
Accueil Recherche
Recherche Début page
Début page Contact
Contact Imprimer
Imprimer Accessibilité
Accessibilité