Maladie de Lyme / Borréliose de Lyme
La maladie de Lyme est une maladie bactérienne. Elle est multiviscérale et multisystémique et elle évolue sur plusieurs années ou décennies, en passant par trois stades.
| Maladie de Lyme Classification et ressources externes |
|
| CIM-10 | A69.2 (ou A69.2+ pour Méningite (basilaire) (cérébrale) (spinale) (à) au cours de maladie de Lyme) |
|---|---|
| CIM-9 | 088.81 |
La maladie de Lyme est une maladie bactérienne. Elle est multiviscérale (pouvant affecter divers organes) et multisystémique (pouvant toucher divers dispositifs) et elle évolue sur plusieurs années ou décennies, en passant par trois stades (ces stades étant théoriques, car en réalité plus ou moins différenciés et quelquefois entrecoupés de périodes de latence, et ils peuvent se chevaucher pour certains symptômes). Non soignée et sans guérison spontanée au premier stade, après une éventuelle phase dormante, cette maladie peut à terme directement ou indirectement affecter la majorité des organes humains, de manière aiguë et/ou chronique avec des effets différents selon les organes et les patients, et finalement conduire à des handicaps physiques et mentaux ou alors à la mort. Des séquelles et rechutes sont envisageables.

Elle est classée parmi les «borrélioses» parce qu'induite par des bactéries du genre Borrelia et parmi les «maladies à tique» car transmise (exclusivement ou presque, semble-t-il) par des piqûres de tiques. C'est l'une des deux grandes formes de borréliose (maladies infectieuses bactériennes véhiculées et transmises à l'homme par les tiques ou des poux) ; les autres étant les borrélioses tropicales.
Pour des raisons toujours mal comprises, elle est en plein développement, surtout en Europe, dans l'est et l'ouest des États-Unis et semble-t-il moindrement en Alaska et au Canada. Elle est devenue la plus fréquente de l'ensemble des maladies transmises à l'Homme par des tiques dans l'hémisphère nord.
Synonymes
La maladie de Lyme (ou Borréliose de Lyme) a aussi été antérieurement appelée «érythème chronique migrant de Lipschutz» ou «méningo-radiculite de Garin et Bujadoux».
Histoire de la découverte ou redécouverte de cette maladie
Les borrélioses existent probablement depuis longtemps, mais la maladie de Lyme, comme telle, tire son nom d'une ville du Connecticut (Lyme) où elle a pour la 1ère fois été suspectée vers 1975.
Deux mamans de cette ville ayant des enfants diagnostiqués comme victimes d'une forme d'arthrite rhumatoïde juvénile avaient observé que de nombreux autres enfants de la commune présentaient des problèmes identiques. Des épidémiologistes de l'université Yale alertés par ces mères sont venus sur place faire une enquête. Ils ont rapidement mis en évidence une situation particulièrement atypique :
- la prévalence d'oligoarthrite était dans cette commune 100 fois plus élevée que celle l'arthrite rhumatoïde juvénile aux États-Unis.
- Les nouveaux cas étaient plus nombreux en été et particulièrement nettement répartis en foyers géographiques.
- Pour 51 cas recensés (en 4 ans), l'enquête épidémiologique a rapporté que 13 patients se souvenaient avoir été piqués par une tique dans les 4 mois précédant les symptômes d'oligoarthrite. Ils se souvenaient aussi d'un érythème au niveau de la piqure. L'étude d'un cas groupé de 39 enfants touchés par ces arthrites et vivant dans la ville ou aux environs de la ville de Lyme a montré que le taux d'arthrites était dans cette zone de 425 cas pour 100 000 habitants (contre 10 en moyenne aux États-Unis à cette époque). Néanmoins de fortes variations se dessinaient selon les sous-secteurs concernés.
Les épidémiologistes ont alors soupçonné une maladie infectieuse qu'ils ont appelé «arthrite de Lyme» [1], [2], [3].
Une étude de l'évolution de la maladie a ensuite mis en évidence la fréquence d'un érythème migrant (EM), de symptômes neurologiques et d'autres complications, dont cardiaques. Ce caractère multisystémique a fait renommer la maladie «maladie de Lyme». Mais on ne savait toujours pas comment soulager les jeunes victimes, et l'agent infectieux de cette maladie restait inconnu (virus ? bactérie ? parasite ?).
En réalité, deux des symptômes de cette maladie (dont l'un ne se manifeste jamais aux États-Unis) avait été décrits antérieurement en Europe du nord ;
- En 1910, Arvid Afzelius (dermatologue suédois) avait noté la naissance d'une lésion dermatologique en forme d'anneau, suivant quelquefois une piqure de tique Ixodes.
- En 1883, un médecin allemand, Alfred Buchwald, avait décrit (à Breslau) une autre anomalie de peau, qui semble être ce qu'on appelle actuellement l'acrodermatite chronique atrophiante, mais Buchwald ne l'a pas relié à une piqure de tique, et ce symptôme n'était pas présent à Lyme.
- En 1922, ce sont ensuite les médecins français Garin et Bujadoux qui ont décrit la maladie, à partir d'un symptôme de paralysie «plus ou moins grave, quelquefois mortelle, consécutive à la piqûre de tiques» (Ixodes hexagonus ) [4]. Ces deux médecins pensaient qu'il s'agissait d'une maladie proche de celle décrite en Australie, en Colombie anglaise, en Afrique du Sud, par Nuttal[5], Hawden[6], Strickland [7].. Les deux français l'attribuent alors à un «virus» qu'il faudrait rechercher non dans le sang mais dans les tissus nerveux.
Au début des années 1980, une autre maladie émergente, la fièvre pourprée des Montagnes Rocheuses (maladie induite par des rickettsies transmises par des tiques) inquiétait les épidémiologistes. Willy Burgdorfer (médecin et entomologiste) se rend alors à Long Island (État de New York dans le nord-est des États-Unis) pour y étudier l'éventuelle présence de rickettsies dans des tiques de chiens Dermacentor variabilis . Il n'y trouve aucune rickettsie et se tourne par conséquent vers d'autres espèces de tiques se nourrissant sur des animaux sauvages et qui quelquefois piquent l'Homme. Il a alors la surprise de trouver des spirochètes dans le tube digestif d'une autre tique Ixodes scapularis (aussi appelée à cette époque Ixodes dammini) [8].
D'autres études ont ensuite montré que les «arthrites de Lyme» étaient bien des manifestations quelquefois particulièrement tardives d'une parasitose bactérienne transmise par des tiques.
En 1981, Burdorgfer, dans un article de la revue Science [8] dit suspecter l'agent infectieux ; une bactérie spirochète souvent trouvée dans le tube digestif et la salive de la tique Ixodes scapularis (dite «tique du cerf» en Amérique du Nord). A. Barbour, son collègue de laboratoire parvint à cultiver ces spirochètes dans un milieu de Kelly modifié[9]. Peu après, on détecte aussi en Europe des spirochètes qui semblent identiques dans des tiques Ixodes ricinus prélevées en Suisse [10], [11]).
En 1982, Burgdorfer met en culture des spirochètes prélevés dans l'intestin de tiques collectées en zone d'endémie de la maladie de Lyme, et il les inocule à des lapins. 10 à 12 semaines après, ces lapins ont développé un érythème migrant montrant que ce spirochète pouvait être la cause de la maladie de Lyme. Burgdorfer a aussi mis en évidence une forte réaction entre le sérum de malades et la bactérie. C'est en son honneur qu'on nommera cette bactérie Borrelia burgdorferi. La culture in vitro de ces spirochètes a alors permis des études bactériologiques, plus fines, expérimentales, moléculaires et immunochimiques. Le spirochète fut en 1984 appelé Borrelia burgdorferi[12], avant qu'on ne comprenne qu'il en existait différentes variétés provoquant des symptômes différents.
La responsabilité de ce spirochète chez l'Homme sera confirmée en 1983 en l'isolant dans le sang et la peau de victimes de la maladie de Lyme [13] [14], avant qu'on ne découvre d'autres espèces de borrelia, aussi hébergées par de nombreux oiseaux, petits mammifères (souris, écureuils, musaraignes et autres petits vertébrés [15]). Une partie des autres borrélies véhiculées par les tiques provoquent chez l'Homme des symptômes équivalent ou proches de ceux induits par B. burgdorferi. On en connait actuellement plus d'une trentaine d'espèces.
Maladie émergente ?
La maladie de Lyme est reconnue comme faisant partie des maladies émergentes, car non évoquée par la littérature ancienne, et car le nombre des tiques, de tiques infectées, et/ou le nombre de patients infectés semblent (depuis quelques décennies) rapidement augmenter en Amérique du Nord (environ 3 millions de cas des années 1970 aux années 2000), comme en Europe et peut-être en Afrique.
À ce jour, on estime, selon les situations géographiques, qu'il peut y avoir jusqu'à 30% des tiques contaminées en France et jusqu'à 60% en Autriche [16]. Cependant la connaissance de cette maladie et de son cycle est toujours lacunaire, et ne reflète pas les réalités de terrain, variables selon les zones (plus ou moins contaminées) et selon divers facteurs de risque ou selon les aléas météorologiques.
Tandis qu'aux États-Unis par exemple, on peut voir des panneaux prévenant les promeneurs qu'ils traversent une zone à risque, la maladie a été tardivement reconnue et suivie en France tandis qu'en Autriche ou en Allemagne, le problème est depuis plus longtemps reconnu comme un problème important de santé publique.
Elle est peut-être sous-diagnostiquée car les symptômes sont variables selon les individus et les bactéries parasites, et sauf l'érythème migrant (qui n'est pas systématique et peut être confondu avec d'autres érythèmes), peuvent être confondus avec ceux d'autres maladies. De plus, des co-infections par des tiques aussi porteuses d'autres microbes (responsables de la Méningo-encéphalite verno-estivale - ou FSME : Frühsommer-Meningo-Enzephalitis en allemand) peuvent fausser les diagnostics.
Plusieurs explications sont avancées pour expliquer le rapide développement de cette maladie, dont :
- la fragmentation écologique des paysages, qui facilite en Amérique du Nord la souris à pattes blanches qui nourrit les tiques vectrices de la maladie de Lyme (plus le paysage est fragmenté par des routes, plus ces souris sont nombreuses et plus elles sont porteuses de borrélies, et plus les tiques sont nombreuses et infectées) ;
- l'effet de perturbations micro- et macroclimatiques, liées à des phénomènes globaux (dérèglement climatique) ou localement à des modifications d'occupation et d'état des sols (drainage, fragmentation forestière, coupes rases... ). On a en effet montré que la température et l'humidité influençaient fortement le comportement de tiques porteuses de borrélies : elles sont deux fois plus mobiles, et recherchent plus activement des proies lorsqu'il fait chaud et sec ;
- modifications des populations faunistiques (ex. : agrainage du gibier et cultures cynégétiques causant en l'absence de prédateurs sauvages une augmentation des populations de sangliers ou de cervidés porteurs de tiques et des phénomènes de promiscuité favorables aux zoonoses) ;
- régression de prédateurs occasionnels des tiques : lézards, tritons, salamandres, jeunes grenouilles et jeunes crapauds, avant qu'ils ne recherchent des proies plus grandes, ou peut-être de certains invertébrés prédateurs des sols forestiers ou vivant dans le bois mort. Ces espèces ont effectivement fréquemment fortement régressé dans les milieux où les tiques pullulent maintenant ;
- des raisons mal comprises : diverses (augmentation du nombre et circulation accrue des rongeurs (aussi favorisés par l'agrainage du gibier) et/ou disparition de leurs prédateurs) ; il n'est pas exclu qu'une régression des parasites des tiques (exemple : Ixodiphagus hookeri dont le nom latin veut dire «mangeur de tiques») qui pouvaient contribuer à en contrôler les populations puissent aussi être en cause,
- des facteurs comportementaux : ainsi en Israël, les borrélioses diminuent dans la population civile, mais augmentent chez les militaires qui y sont plus exposés lors des exercices au sol (ramper sur le sol, dormir par terre sont des facteurs de risque).
Agents, hôtes et vecteurs

Ils changent selon les cas et selon les régions du monde.
Les agents
Ce sont toujours des bactéries spirochètes du genre Borrelia. Mais elles agissent quelquefois de concert avec d'autres pathogènes, à l'occasion d'une coinfection.
«Borrelia burgdorferi sl (sensu lato) » sert à désigner un «complexe» d'une trentaine d'espèces de borrélies dont quatre sont des pathogènes capables de déjouer le dispositif immunitaire humain : B. burgdorferi sensu stricto (ss), la plus présente aux États-Unis et B. garinii, B. afzelii et B. spielmanii en Europe. Chacune de ces bactéries semble préférentiellement cibler certains organes. Toutes provoquent un érythème en première phase, mais B. garinii a plutôt des effets neurologiques, B. burgdorferi ss provoque plutôt des arthrites tandis que l'ACA évoque plutôt B. afzelii. Les quatre espèces pathogènes circulent en Europe tandis qu'une seule, B. burgdorferi sensu stricto, est connue aux États-Unis.
Cette maladie est causée par au moins 4 espèces d'un genre de bactéries (les borrélies ou Borrelia) classées parmi les spirochètes à cause de leur caractère serpentiforme et spiralé [17] :
- Borrelia burgdorferi sensu stricto (ou st) , est le spirochète qui est la cause presque exclusive de la maladie de Lyme en Amérique du Nord (Canada, États-Unis, Alaska) où il cause en particulier des arthrites de Lyme et des douleurs de type rhumatismales (mais toujours sans acrodermatite) ;
- Borrelia burgdorferi (sensu lato) , qui sert à désigner un complexe de plusieurs espèces de borrélies pathogènes rencontrées en Eurasie. En Europe, dans ce groupe, B. Burdogferi est plus rare, tandis que d'autres borrélies (Borrelia afzelii «sous groupe européen» et Borrelia garinii «sous groupe européen» surtout) semblent impliqués dans la majorité des cas européens et asiatiques, mais aussilquefois que B. spielmanii .
Lorsque on parle de plusieurs espèces réunies sous le terme générique de «Borrelia burgdorferi sensu lato» (bien préciser dans ce cas «sensu lato» pour éviter les confusions et erreurs de diagnostic. - Borrelia afzelii est reconnue comme étant plutôt dermatotrope (ciblant la peau en y provoquant surtout l'acrodermatite chronique atrophiante et des symptômes évoquant ceux d'un lichen plan (sclérodermie située)
- Borrelia garinii est reconnue comme plutôt neurotrope (ciblant les nerf),
mais les manifestations cliniques se chevauchent fréquemment[18].
Les vecteurs
Les borrélies peuvent infecter de très nombreux hôtes animaux, mais comme pour l'ensemble des zoonoses on suspecte l'existence d'espèces-réservoir prédominantes (par exemple la souris à pattes blanches pour B. burdorgferi en Amérique du nord). Ces espèces-réservoir peuvent être localement favorisées dans certaines conditions (nourriture abondante, disparition de leurs prédateurs naturels).
On a en premier lieu cru que les petits rongeurs et les cervidés étaient toujours les principaux vecteurs des tiques elles-mêmes vectrices de borrélies pathogènes. Cependant des analyses récentes[19] (2004/2005) de restes de repas sanguin prélevés chez des nymphes de tiques en quête d'un nouveau repas ont montré - malgré les niveaux assez bas de détection (49, 4%, n = 322) - que les petits rongeurs ne sont pas forcément en cause. Cette étude a confirmé les résultats d'un précédent travail. Sur le territoire reconnu (en Irlande), les rongeurs étaient peu importants comme hôtes de B. burgdorferi sl ; C'étaient dans ce cas des passereaux qui étaient les hôtes beaucoup prédominants de la tiques Ixodes ricinus (Cet ordre regroupe à peu près la moitié des espèces d'oiseaux). Cette dernière était plus abondante que dans l'étude précédente, mais la prévalence de l'infection des nymphes de tiques par la totalité des souches de Borrélies (Borrelia burgdorferi sl) était la même (12, 2 % des nymphes étaient infectées par au moins une espèces de borrélie), et la part relative des diverses espèces de borrélies (genospecies) était aussi identique (B. Garinii et B. valaisiana ont été les souvent trouvées, B. burgdorferi ss étant la moins fréquente, tandis que B. afzelii était trouvée à une fréquence intermédiaire).
39% des nymphes infectées l'étaient par plusieurs espèces de borrélies (pourcentage jugé anormalement élevé par les auteurs de l'étude qui ont même pour la première fois en Irlande détecté une borrélie responsable d'une fièvre récurrente à Spirochète). Ces auteurs estiment que l'analyse des restes des précédents repas de sang des tiques en quête de nourriture est un moyen intéressant de déterminer l'origine de certains hôtes des borrélies, et qu'il pose des questions nouvelles concernant la spécificité des hôtes de B. burgdorferi sl et l'étendue des espèces infectées ou vectrices.
Les Borrelia pathogènes semblent en particulier transmises aux humains par des tiques du genre Ixodes [20].
Le vecteur semble toujours (ou presque toujours ?) être une tique infectée par une ou plusieurs espèces de Borrelia (Borrelia burgdorferi essentiellement aux États-Unis, avec dans ce cas pour vecteurs principaux Ixodes scapularis (=I. dammini) dans le Nord et l'Est du pays, et moindrement Ixodes pacificus dans l'Ouest (5% à peu près des cas déclarés aux États-Unis).
D'autres borrélioses de Lyme sont véhiculées en Europe et Asie par d'autres tiques ; Ixodes ricinus en particulier en Europe et Ixodes persulcatus en Asie tempérée et froide (presque tout l'ex-URSS).
Des spirochètes, dont des borrélies, sont quelquefois trouvés dans d'autres vecteurs capables de piquer l'Homme. Ceci a soulevé l'hypothèse de transmission de spirochètes (plus rarement) par des moustiques, punaises, taons, ou alors sangsues est quelquefois évoquée, mais cette hypothèse ne fait pas l'objet d'un consensus.
Épidémiologie ; Modalités et temporalités de contamination
Une transmission directe mère - enfant in utéro est envisageable (mais non via l'allaitement) [21].
Selon le Centers for Disease Control and Prevention (agence gouvernementale étasunienne), aucune transmission de personne à personne (par toucher, baiser, ou acte sexuel) n'a été prouvée, quoique quelques borrélies puissent être trouvées dans la majorité des fluides corporels des malades[22].
Aucun cas de transmission par transfusion sanguine n'a été recensé, et les poux ne semblent pas non plus vecteurs de cette maladie (tandis qu'ils véhiculent d'autres borrélioses, en zone tropicale).
En climat tempéré, la contamination se produit presque toujours ;
- lors de parcours en forêt ou lande, le long de routes forestières, quelquefois dans les jardins, le bocage ou d'autres milieux naturels ou semi-naturels riches en herbacées et petits ou grands mammifères.
- du début du printemps à la fin de l'automne.
Le risque de contracter la maladie de Lyme doit être prise au sérieux pour toute promenade en forêt ou zone boisée en Amérique du nord-est ou de l'ouest , en Europe centrale et de l'Ouest (dont en Suisse en Belgique et en France ; tout spécifiquement en Alsace ; région qui totaliserait selon l'INVS la moitié des cas français à elle seule) ; En France, la tique I. ricinus, vectrice des borrélies est présente presque partout, hors littoral méditerranéen et au-dessus de 1000/1200m [23]
Il existe des activités à risque (une étude sérologique laisse penser que 15 % des chasseurs ont été en contact avec des borrélies. Les activités naturalistes et les promenades dans le sous-bois exposent à un risque plus élevé. La maladie de Lyme est , comme l'une des Spirochétoses (maladie professionnelle) reconnue comme une maladie professionnelle pour certains métiers à risques tels que «forestier», bûcheron, ... ).
L'introduction de la bactérie — et une éventuelle co-infection — sont facilitées par un double processus[24] :
- des molécules anesthésiques sont injectés par la tique lorsqu'elle enfonce son rostre dans la peau.
Au contraire de une idée répandue, les tiques véhiculant ces spirochètes ne mangent pas que du sang (elles ne piquent presque jamais directement un vaisseau sanguin et on ne saigne quasiment jamais lorsque la tique tombe ou après avoir retiré une tique (même en pressant sur la plaie). La tique pique fréquemment au contraire une zone de peau peu irriguée. Elle y enfonce son rostre jusqu'au derme dans lequel elle injecte une enzyme digestive proche de celles qu'injectent les araignées à leurs proies. Cette enzyme digère un certaine quantité de tissus du derme que la tique peut ensuite aspirer avant d'envoyer dans cette «poche» une nouvelle dose de salive et poursuivre ce processus plusieurs jours durant (tandis que le moustique ou la punaise se gorgent rapidement de sang). - Des immunodépresseurs sont aussi injectés lors de la piqure, empêchant ou limitant, à ce stade, le phénomène inflammatoire[24]. Ainsi l'hôte ne ressentant pas de douleur (sauf s'il est devenu allergique à la salive de tique, suite à une sensibilisation permise par des piqures récurrentes) ne cherche pas à se débarrasser de la tique.
Ceci convient idéalement aux borrélies qui déjouent ainsi plus aisément la réponse du dispositif immunitaire (globules blancs, anticorps... ). Les borrélies ont en effet un mode de locomotion énormément plus performant que celui de nos cellules immunitaires, à condition d'être dans un milieu ayant la consistance d'un gel et non de l'eau, consistance qui est celle du liquide synovial, des humeurs vitreuses (yeux) ou qu'on trouve dans les fibroblastes, cellules adipeuses, cellules gliales, cartilages que les borrélies infectent le plus aisément (elles sont peut-être aussi présentes dans les cellules osseuses). Des indices d'immunodépression induite par les borrélies à d'autres stades de développement de la maladie existent[24], mais restent à confirmer ou à mieux expliquer.
- Au stade suivant, l'inflammation apparait (manifestée par l'érythème), mais les globules blancs ne semblent toujours pas capables de capturer les borrélies, ce qui favorise l'infection (inversement, accroître le recrutement des neutrophiles vers le point d'infection diminue cette dernière [25].
- On a montré chez la souris de laboratoire, que B. burgdorferi tandis qu'il est toujours dans la tique, et que cette dernière commence à se nourrir du sang de son hôte, est capable de fixer sur sa propre enveloppe des protéases (plasmine) de son futur hôte [26] Le rôle de l'activateur tissulaire du plasminogène de l'hôte a été étudiée grâce à une souche de souris ne produisant pas de plasminogène (Plg). Le Plg n'a pas été détecté sur les borrélies provenant de tiques non nourries, mais est présent sur les tiques qui se sont nourries du sang de leur hôte. L'activateur du plasminogène provient du sang aspiré par la tique dans l'hôte. Sans Plg, B. Burdorgferi semble incapable de diffuser efficacement dans la tique (et secondairement d'augmenter le nombre de spirochètes pouvant infectant l'hôte, une souris ici), mais ce Plg ne semble pas critique pour la transmission et l'infection à l'hôte. Ces borrélies sont par conséquent capables d'utiliser une protéase empruntée à un vertébré pour diffuser dans un vecteur invertébré (la tique), ce qui souligne une interaction complexe et ancienne entre vecteur, agent pathogène et hôte dans le cycle de vie du pathogène.
En cherchant à tester l'efficacité d'un vaccin basé sur la protéine de surface de B. burgdorferi OSP A (OSP signifiant "outer surface protein" et A désignant cette protéine spécifique), on a remarqué que le vaccin ne protégeait les souris de l'infection que dans une courte fenêtre temporelle. La protéine OSP A est bien reconnue par les anticorps lorsqu'elle est présentée par la surface externe de spirochètes présent dans l'intestin de nymphes de tiques non nourries. Mais inversement l'essentiel des borrélies présentes dans l'intestin et les glandes salivaires d'une tique alimentée n'ont pas attiré ces mêmes anticorps. Ainsi, OSPA n'est pas immunologiquement exprimée (cachée ou non exprimée ?) sur l'enveloppe de la majorité des Spirochètes lorsque la tique commence à se nourrir, et par conséquent lors de la transmission du vecteur à l'hôte vertébré. Des souris ont été immunisées par des anticorps ciblant l'OSPA à des moments différents comparé à la piqure de tique. Quand l'anticorps anti-OSPA a été administré aux souris, avant ou au moment du repas de la tique, les anticorps présents dans le sang aspiré par la tique ont bloqué le développement des borrélies et l'invasion des glandes salivaires de la tique par ces dernières, et les souris ont été effectivement protégées de l'infection par B. burgdorferi. Mais lorsque l'anticorps anti-OSPA a été administré à des souris 48 heures après la morsure par la tique, les borrélies ont persisté et se sont développés dans les nymphes et les souris ont été infectées malgré les anticorps circulant dans leur sang, et présents dans le sang aspiré par la tique. L'immunité contre l'OSPA ne semble par conséquent être efficace que durant une étroite fenêtre temporelle, au début du repas de sang seulement[27].
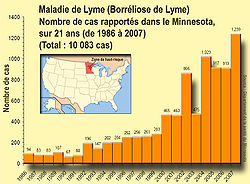
Prévalence
La prévalence de la maladie semble corrélée à celle des tiques et au pourcentage de ces tiques porteuses de borrélies, mais les données de prévalence manquent dans énormément de pays et régions car la borrélisose de Lyme est toujours mal repérée par les médecins à cause de symptômes quelquefois peu spécifiques. De plus, en dépit de sa particulièrement forte et rapide progression, elle n'est pas partout une maladie à déclaration obligatoire (Aux États-Unis, elle l'est depuis 1981, mais les données sont reconnues comme identiques entre elles qu'à partir de 1991 car avant cette date certains états ont rapporté des cas groupés sans information individuelle caractérisant chaque cas). De plus, les études antérieures de séroprévalence ont pu être faussées par la spécificité des tests de diagnostic qui font que la maladie a quelquefois été certainement sous-diagnostiquée. Les rares études sur la prévalence des borrelia chez les tiques montrent de fortes variations régionales. Aux États-Unis, le CDC a en 2008 recommandé[28] d'intensifier la surveillance des borrelia, par un meilleur suivi de la population active mais également via l'utilisation des données animales (exemple : tests sérologiques de chiens et surveillance d'espèces vectrices sauvages) pour compléter les données disponibles et et apporter une meilleure compréhension de cette maladie infectieuse émergente.
- À titre d'exemple, deux études sérologiques ont dans un chenil militaire français de Suippes (Champagne-Ardenne) testé 210 chiens en 1991, puis 245 l'année suivante, confirmant une borréliose de Lyme. En 1993 la prévalence des spirochètes a été étudiée chez les 4 espèces de tiques trouvées sur le site ; Ixodes ricinus a été trouvée porteuse de Borrelia afzelii (responsable de l'acrodermatite chronique atrophiante associée à une des variantes européennes de la maladie de Lyme).
Le pourcentage des chiens dont la sérologie démontre un contact antérieur avec des Borrelias et celui des tiques porteuses de la bactérie étaient dans ce cas moindres que dans d'autres régions de France où des enquêtes éco-épidémiologiques identiques ont été faites.
Prévalence de Borrelia chez la tique
Bien que certaines zones soient épargnées (au-dessus de 1500 mètres en suisse [29], il ne semble pas y avoir de zone limitées d'endémisme, cependant la prévalence (le % d'individus infectés) de l'infection de la tique vectrice Ixodes ricinus par une Borrelia fluctue fortement les régions géographiques.
- A titre d'exemple, en Suisse, au début des années 2000, la prévalence variait de 9 à 40% selon les régions chez les nymphes de la tique I. ricinus, avec un taux de contamination plus important chez la tique adulte que chez la nymphe, tandis qu'elle variait de 22 à 47% chez les tiques adultes (ce qui laisse penser que le parasite n'affecte pas la tique) [30].
Prévalence de Borrelia chez l'Homme
Les données sont lacunaires. Dans les années 2000, elle est la première maladie vectorielle dans l'hémisphère nord, avec
- 15 000 cas annuels en moyenne aux États-Unis,
- plus de 50 000 cas/an en Europe, où il semble exister un gradient positif d'Ouest en Est . Le taux d'incidence y fluctue de moins de 5 pour 100 000 habitants (en Irlande) à 300 à 350 en Autriche (pays qui semble le plus touché). L'incidence est globalement croissante d'ouest en est , avec néanmoins des taches de forte endémie dans des régions d'autre part épargnées.
- En France, l'incidence moyenne était à la fin des années 1980 estimée à 16, 5 cas pour 100 000 (Source : réseau de médecins sentinelles Dournon et coll. 1989), avec des chiffres cités de 20 à 50 cas pour 100 000 habitants (ex. : en France, 40 cas pour 100 000 hbts ont été relevés vers 1990 dans le Berry-Sud[31]). L'Institut Pasteur estime qu'il y a vers 2005 à peu près 10 000 nouveaux cas par an. L'Est et le centre sont les plus touchés, avec jusqu'à plus de 200 cas/100 000 habitants en Alsace. Des études montrent que les tiques infectées sont beaucoup répandues en Europe, sauf sur une petite bande de territoire en zone méditerranéenne ainsi qu'à partir d'une certaine altitude[32].
- En Belgique, on décrit plus de 500 nouveaux cas de borréliose caractérisée chaque année (Godfroid et al., 1995).
- En Suisse francophone, de 1996 à 1997, on estimait que neuf personnes étaient malades pour 100 000 personnes dans le canton du Valais, et de 95 personnes sur 100 000 pour le canton de Neuchâtel. [33] En 1991 la séroprévalence était de 3, 9 à 6% de la population suisse (pour les IgG) [34].
Au début des années 1990, 10, 7% des donneurs de sang présentaient des anticorps de type IgG et 4, 1% présentaient des anticorps de type IgA. 5 et chez les forestiers cette séroprévalence peut s'élever à 35% (avec uniquement 3, 5% présentant des symptômes cliniques dans les 10 ans suivants) [35].
En Suisse toujours, à la fin du XXème siècle, 209 à 285 cas d'érythème migrant étaient chaque année signalés à l'Office fédéral de la santé publique (OFSP), mais la déclaration obligatoire a été à cette époque supprimée. - Aux États-Unis, selon les CDC, sur 14 ans (de 1992 à 2006), 248 074 cas de maladie de Lyme ont fait l'objet d'un signalement volontaire, rapporté à la CDC par les services de santé des 50 États du pays. L'augmentation annuelle pour ces 14 années a été de 101% (de 9 908 cas en 1992 à 19 931 cas en 2006). La maladie de Lyme est ainsi devenue la maladie infectieuse transmise par un vecteur la plus souvent rapportés aux États-Unis.
93% des cas viennent de 10 Etats (Connecticut, Delaware, Massachusetts, Maryland, Minnesota, New Jersey, New York, Pennsylvanie, Rhode Island et le Wisconsin). L'incidence était plus élevée dans le nord-est et centre-nord du pays, et chez les enfants de 5 ans à 14 ans. 53% de l'ensemble des cas ont concerné des hommes. Uniquement légèrement plus de 65% des patients atteints de la maladie ont eu un érythème migrant, le plus souvent apparu entre juin et juillet, et 37% des patients repérés ont déclaré une Arthrite de Lyme. Le nombre d'enfants et de jeunes hommes atteint par la maladie augmente proportionnellement plus vite que le nombre de malades des autres groupes. Pour cette période (1992->2006), le CDC dispose d'information sur l'origine ethnique de 70.0% des cas rapportés (166 194 patients) : 94, 1% d'entre eux (soit 156 346 personnes) étaient identifiés comme blancs, contre uniquement 1, 7% (2 765 personnes) comme noirs et 0, 8 % (1 299 personnes) comme asiatiques ou habitant des îles du Pacifique et 0, 3% (452 personnes) comme amérindiens natifs (en Alaska) ; les populations blanches semblent beaucoup plus touchées que les autres, peut-être pour partie en raison d'un accès plus habituel aux forêts giboyeuses riches en tiques, et en raison d'une probable meilleur accès au soin ainsi qu'à la détection.
Quelques erreurs de diagnostic sont envisageables dans le sud-est du pays où des morsures de tiques sont fréquemment suivi d'un rash qui évoque l'érythème de la maladie de Lyme, mais qui n'est pas causé par B. burgdorferi[36].
Durant ces 14 ans d'observation, les symptômes rapportés chez les moins de 20 ans variaient fortement selon l'âge ; Aux États-Unis, les de 10-14 ans représentaient le plus faible pourcentage d'érythème migrant (58, 2% uniquement en déclarent), mais le pourcentage le plus élevé d'arthrite (38, 7%). - Facteur d'altitude et de latitude : Dans les zones polaires les tiques disparaissent, ou si elles y sont provisoirement apportées par des oiseaux, elles y meurent sans pouvoir se reproduire. Dans les zones arides, certaines espèces survivent autour de points d'eau ou en particulier dans les terriers.
Le facteur d'altitude est plus complexe[32] : La limite d'altitude au-delà de laquelle la tique n'est plus présente fluctue fortement selon les caractéristiques biogéographiques du territoire reconnu : par exemple I. ricinus ne se rencontre plus au-dessus de 600 m en Écosse [37], mais est trouvée en France au-delà de 1300-1500 m dans des zones énormément plus hautes et froides, mais également plus densément boisées (et semble -t-il jusqu'à au moins 1700 m dans les Pyrénées [38]), et en Italie, au-delà de 1300 m (Rizzoli et al., 2002). Le réchauffement climatique semble permettre aux tiques ainsi qu'aux micropathogènes qu'elles véhiculent de remonter vers les pôles et en montagne en altitude.
Les borrélies peuvent déjouer le dispositif immunitaire
On connaît toujours mal les interactions entre immunité et spirochètes, mais ces bactéries font preuve de surprenantes capacités à se jouer du dispositif immunitaire humain. Les patients semblent tous réagir différemment, avec une réponse immunitaire plus ou moindre, allant jusqu'à développer une immunité cellulaire sur-stimulée ou hyper-activée, provoquant une cascade auto-immune et des symptômes évoquant ceux de maladies auto-immunes.
- Les borrélies (comme certains virus tels que ceux de la grippe et du Sida) peuvent rapidement muter et changer leur protéines de surface, gênant la production d'anticorps et par suite freinant leur détection et leur attaque par les dispositifs de défense de l'immunité.
- Les borrélies sont peu présentes dans le sang et la lymphe (ou elles y sont vulnérables aux globules blancs et en disparaissent par conséquent rapidement).
- Les foyers d'infection peuvent se déplacer temporellement dans le corps, d'un organe à l'autre,
- Les borrélies peuvent aussi se protéger dans des kystes sphériques (et peut-être dans certains organes), échappant ainsi aux antibiotiques ainsi qu'aux globules blancs.
- On a montré dans les années 2000 les capacités motrices exceptionnelles (et bidirectionnelles) des spirochètes et tout spécifiquement de certaines borrélies. Leur mode locomoteur et leur forme spiralée semble - dans certains milieux de l'organisme - les aider à aisément distancer les macrophages phagocytaires qui devraient normalement les détruire comme corps étranger. In vitro, les spirochètes se déplacent le mieux et le plus rapidement dans des «gels», qui sont les milieux qui inhibent la motilité de la majorité des autres bactéries.
En 2008, l'observation en temps réel en vidéomicroscopie à contraste de phase a montré [39] que Borrelia burgdorferi se déplace à une vitesse moyenne de 1636 micromètres par minute (moyenne pour 28 bactéries observées), avec une vitesse maximale de 2800 µm/mn chez 3 des bactéries observées, soit la vitesse la plus rapide enregistrée pour un spirochète, et de deux ordres de grandeur au-dessus de la vitesse d'un polynucléaires neutrophiles humain connu être la plus rapide de nos cellules mobiles.
Les spirochètes disposent de 2 séries de flagelles leur servant à se déplacer dans des directions opposées le long de leur axe (en avant ou en arrière). Au contraire des autres bactéries mobiles connues, il s'agit de flagelles internes (organites dites «endoflagelles» ou «flagelles périplasmiques»).
Ces flagelles baignent dans le milieu interne (periplasme) de la cellule bactérienne. Chaque flagelle est attaché par l'une de ses deux extrémités à l'une des extrémités de la cellule. Leur longueur change selon l'espèce de spirochète. Chez certaines espèces les flagelles (dont le nombre fluctue aussi selon l'espèce) se chevauchent au centre de la cellule. Les flagelles sont animés d'un mouvement rotatoire dans le milieu interne (espace périplasmique).
Ces flagelles internes sont particulièrement peu efficaces dans un liquide particulièrement fluide : À la manière d'un vers de terre dans l'eau, la bactérie doit y effectue des flexions et rotations qui lui font consommer énormément d'énergie. Elle n'y progresse qu'à une vitesse d'environ 4, 25 μm/s, ou 255 μm/min [40]. Cependant, à la manière du ver de terre dans un substrat qui lui oppose une résistance, les borrélias deviennent particulièrement mobiles lorsque le degré de «viscoélasticité» du milieu augmente ; la bactérie devient ainsi «très» rapide (jusqu'à ∼ 2000 μm/min) et bien mieux capable de se diriger dans un fluide plus visqueux identique au milieu extracellulaire de notre organisme (par exemple dans la méthylcellulose dont les propriétés de viscosité imitent celles de la matrice extracellulaire, de celles des différents acide hyaluronique qui composent nos humeurs vitreuses et de celles des lubrifiants articulaires dont synovie). La vitesse des Spirochètes observés dans de telles "gels" est directement liée à la viscoélasticité du milieu, plus qu'à sa teneur en nutriments. Ainsi a-t-on observé des spirochètes restant mobiles durant 3 h dans un tel milieu, malgré une teneur en nutriment de 100 fois inférieure à la norme retenue pour les milieux de culture [41], de même que sur les surfaces où elles sont soupçonnées d'être présentes [42] [43].
Le mécanisme expliquant la motilité semble aussi fluctuer selon les espèces de spirochètes. Le modèle mis au point pour les leptospiræ, qui reste convaincant pour certains spirochètes n'explique pas le mouvement de Borrelia burgdorferi qui «nage» différemment et particulièrement efficacement dans les gels. Ses mouvements ont été observés en microscopie, et leur comparaison avec ceux de mutants de la même bactérie, associée à des études moléculaires des protéines et gènes impliqués dans la mobilité devraient bientôt éclairer ce qui la différentie d'autres spirochète de ce point de vue. Ces études et les premières séquences génomiques disponibles montrent déjà que les filaments protéiques qui forment les flagelles internes des spirochètes comptent parmi les plus complexes des flagelles bactériens connus et qu'ils sont organisés et régulés par la plupart de gènes impliqués dans la motilité des spirochètes. Ces organismes semblent par conséquent avoir depuis longtemps co-évolué avec leurs hôtes. L'explosion récente des cas de maladie de Lyme ne s'explique certainement pas par une mutation rendant la bactéries plus adaptée, mais par d'autres facteurs environnementaux facilitant la pullulation des borrelia et/ou des tiques. - un même individu peut par conséquent développer la maladie plusieurs fois ; il n'est pas immunisé par une première guérison tandis que le dispositif immunitaire se montre capable de détecter la bactérie (taux de cytokines élevés).
Ces multiples capacités (vélocité, camouflage) expliquent aussi que les premiers tests de laboratoire soient assez fréquemment négatifs. Certains experts estiment même qu'on ne peut le plus souvent pas éradiquer les spirochètes d'un organisme, mais aider le dispositif immunitaire à les contrôler.
Ceci suggère aussi que ces borrélies diffusent en premier lieu autour de la piqure de tique non pas dans le sang ou la lymphe, mais en "nageant" dans la substance intercellulaire de la peau (plus visqueuse, et où les globules blancs auraient toujours plus de mal à les intercepter). Cette mobilité importante et les chemins empruntés par la bactérie pourrait expliquer la difficulté des organisme-hôte à se débarrasser de ce parasite. Inhiber la capacité de déplacement de la bactérie dans ce milieu pourrait par conséquent être une piste thérapeutique.
Diagnostic
Il est facilité lorsque le médecin constate l'érythème migrant (mais cet érythème n'apparaît pas forcément ou peut être discret), ou que le patient évoque spontanément le souvenir plus ou moins récent d'une ou plusieurs piqûre (s) de tique (s), mais il ne s'en souvient que dans 40 à 80 % des cas (selon les zones et bactéries en causes).
En l'absence d'érythème, en particulier si le patient a été exposé au risque de piqûre de tique, le diagnostic doit être basé sur des tests complémentaires, qui ne sont pas fiables à 100 % :
- Test Elisa : qui ne détecte pas l'ensemble des borrélies, et peut produire des faux-positifs ou des faux-négatifs, à confirmer par conséquent par :
- Western Blot : c'est un test de confirmation ou d'infirmation, connu plus fiable et précis que l'Elisa, mais pour des raisons mal comprises, il ne détecte pas forcément les traces de la bactérie (certainement dans les cas où la bactérie est en phase cystique de dormance (où elle échappe aux antibiotiques), dans un organe bien isolé, ou complètement absente du réseau sanguin). Chez certains patients, la sérologie pour B. burgdorferi sensu lato a été à maintes reprises négative tandis qu'une sérologie plus spécifique s'est montrée positive pour B. afzelli [44].
- PCR sur prélèvement sanguin ou de LCR (liquide céphalo-rachidien) ou alors de liquide intra-articulaire ; la PCR (à condition de concerner un compartiment où la borrélie est présente, synovial par exemple) permet quelquefois de confirmer un diagnostic clinique tandis que la sérologie était négative [45]
- Analyse de biopsies (rarement pratiquées)
- Dosage des anticorps dans le LCR en cas de suspicion d'atteinte neurologique (rarement pratiqué).
Fréquemment, la piqûre est ancienne et oubliée, ou n'a même pas été consciemment perçue par le patient. Le diagnostic est alors compliqué par différents facteurs :
- les tests sont d'interprétation quelquefois complexe (faux négatifs au début et/ou faux positifs en cas d'infection par d'autres spirochètes).
- la maladie peut se déclarer ou réapparaître longtemps (quelquefois plusieurs semaines, mois ou années[46] après la morsure par une tique) et énormément de malades ont oublié ou ne se sont pas aperçu qu'ils avaient été piqués [47]. Par exemple : sur 43 personnes vivant dans 12 communes contiguës du Connecticut ayant présenté un érythème migrant ou une arthrite de Lyme, ou les deux, en été ou automne 1977, 9 uniquement (21%) se souvenaient d'avoir été mordues par une tique au point de lésion d'origine de la peau (3 à 20 jours avant les symptômes, 12 en moyenne), et un seul patient avait pu identifier la tique (qui était Ixodes scapularis). Comparé à 64 de leurs voisins, ces patients étaient néanmoins plus nombreux à posséder des chats et animaux de ferme, ainsi qu'à signaler des morsures de tiques sur eux-mêmes ou sur les animaux proches d'eux. L'incidence de la maladie cette année-là (1977) était de 2, 8 cas pour 1 000 habitants dans 3 communes localisées à l'est de la rivière Connecticut, soit 30 fois plus que les 0, 1 cas pour 1 000 habitants observés dans les 9 communes de la rive ouest , où les tiques étaient moins présentes [48]. Dans un cas, 60 % des malades ne se souvenaient pas avoir été piqués [49]. En Suisse, seuls 50 à 70% des patients atteints avaient le souvenir d'avoir été piqués[50].
- les symptômes peuvent être particulièrement atténués (il existe des cas de premier stade asymptomatique, que le consensus médical a en premier lieu recommandé de ne pas traiter).
- la maladie évolue différemment selon les individus, en stades qui peuvent se chevaucher et affecter en même temps, ou de manière successive, des organes différents [16].
- une étude sur 36 malades a montré que la méningite de Lyme se produit fréquemment sans signes méningés et est fréquemment accompagnée par la persistance de borrélies, même après un an de traitement [51].
- la bactérie est connue complexe à cultiver (sa culture ne se pratique en tous cas pas en routine), et il n'y a pas de gold standard microbiologique.
Diagnostic différentiel
Risques d'erreurs de diagnostic : Vu la grande diversité des symptômes, la maladie de Lyme peut conduire à de nombreux diagnostics erronés, comme : sclérose en plaques (une encéphalomyélite ou une myélite peuvent être confondues avec une sclérose en plaques ou bien une compression médullaire), lupus, polyarthrite rhumatoïde, fibromyalgie, fatigue chronique, dépression, maladie d'Alzheimer, maladie de Parkinson, autisme et bien d'autres. La différence étant fréquemment que les symptômes cèdent ici à l'antibiothérapie. De plus, il est arrivé que les tests classiques, faits à plusieurs reprises, ne détectent pas la bactérie chez certains patients.
Aide logicielle informatique : Depuis peu, un logiciel de diagnostic différentiel existe [52]. Il aide à éviter de mauvais diagnostics tels que urticaire, Sclérose en plaques, Maladie de Parkinson, Sclérose latérale amyotrophique, Démence, dépression, crise de panique, psychose, désordres obsessionnels, épilepsie, attaque, anévrismes, lymphome (cutané bénin et malin) et d'autres confusions envisageables sur de nombreux organes lorsqu'il s sont infectés par les borrélies.
Symptômes
Le tableau clinique
Il fluctue fortement, selon le patient et le stade de la maladie, selon l'ou les borrélies en cause et le cas échéant selon l'ou les co-infections. Ces dernières peuvent toujours compliquer le diagnostic et le traitement [53]. Elles sont facilitées par le fait que la tique est vectrice de nombreux parasites. Une bartonellose peut ainsi être conjointe et confondue avec la maladie de Lyme (malgré son rash (érythème) qui peut être particulièrement différent[54].
Au 1er stade, fièvre, maux de tête, fatigue, dépression et fréquemment une éruption cutanée caractéristique (l'érythème migrant) apparaissent dans les 2 à 30 jours suivant la morsure. Ils disparaissent le plus souvent avec un traitement antibiotique adapté (en particulier si le diagnostic et le traitement sont précoces).
Sinon ils évoluent plus ou moins rapidement vers des problèmes articulaires, musculo-squelettiques, cardiaques et neurologique pouvant être récidivants et/ou chroniques, invalidants et complexes à traiter[55]. Une attention spécifique est à porter aux infections acquise avant ou durant une grossesse (car la contamination mère-enfant est envisageable), et par des immunodéficients).
La maladie de Lyme peut affecter divers organes et dispositifs de l'organisme, avec une large gamme, variable, de symptômes non systématiques ;
Tous les malades ne présentent pas l'ensemble des symptômes. Et énormément de ces symptômes ne sont pas spécifiques à la maladie de Lyme, et peuvent apparaître dans d'autres maladies courantes.
De plus, à cause de facteurs mal compris (virulence de la souche de borrélie, immunité du patient, coinfection... ), le temps séparant la piqure ou la période d'incubation de la naissance des symptômes fluctue. Ce délai est le plus fréquemment de 1 à 2 semaines, mais il est quelquefois raccourci à quelques dizaines d'heures, ou au contraire étendu à plusieurs mois ou années.
Les symptômes apparaissent le plus fréquemment en 3 phases (comme pour la syphilis). Les symptômes primaires (du premier stade de la maladie) sont le plus fréquemment constatés de mai à septembre, époque qui correspond au stade nymphal de la tique, responsable de la majorité des infections [56]
Infections asymptomatiques
Elles existent et sont quantitativement toujours mal évaluées dans le monde[57]. Elles semblent présenter des taux variant selon les types de borrélies et les zones biogéographiques reconnues. Elles ont par exemple au début des années 2000 été détectées chez presque 7% des personnes apparemment non malades, mais sérologiquement démontrées infectées par B. burgdorgferi ss aux États-Unis[58], mais le taux d'infection sans symptômes pourrait être énormément plus élevé en Europe [59]. On ne semble pas disposer d'évaluation précise pour les autres souches (européennes ou asiatiques) de borrélies, mais quelques indices montrent que le nombre de cas asymptomatiques pourrait être plus élevé qu'en Amérique du Nord. A titre d'exemple, lors de l'étude (publiée en 2007) d'une récente épidémie de maladie de Lyme chez des ouvriers forestiers de Silésie, 1/3 des cas sérologiquement prouvés étaient asymptomatiques (au moment de l'étude, des symptômes pouvant peut-être apparaître plus tardivement chez ces «malades ») [60].
Stade 1 (ou «primaire»)
- Infection d'origine cutanée, située autour du point de morsure, avec envisageable stade primo-secondaire de début de diffusion systémique
Lorsque l'infection n'est pas complètement asymptomatique, le signe le plus classique et précoce d'un début d'infection est une éruption inflammatoire cutanée (érythème), qui apparaît de 3 à 32 jours après la morsure d'une tique, et qui prend la forme d'une tache circulaire à ovale, rougeâtre de 1 ou 2 cm (grandissant quelquefois ensuite jusqu'à plus de 10 cm de diamètre). Cette tache est quelquefois chaude (Cf. inflammation), mais fréquemment indolore et non prurigineuse (pas de démangeaisons). Elle couvre de façon centrifuge, en pouvant quelquefois migrer pour former un anneau, qui entoure la tache centrale qui reste centrée sur le point de la piqûre de la tique (érythème migrant ou EM) [61]. Fréquemment, la partie centrale reste rouge ou foncée et devient plus indurée. Son bord externe reste aussi rouge, mais plus rarement, la portion de peau localisée entre le centre et le bord retrouve une couleur normale (dans 9% des cas). Quelquefois (surtout chez des personnes qui se font fréquemment piquer, et qui semblent développer des réactions allergiques), une nécrose centrale, ou une vésicule[62] apparaît à l'emplacement de la morsure, peut-être accompagnée d'un prurit intense pouvant persister plusieurs semaines à plusieurs mois, ou alors plusieurs années si la maladie n'a pas été soignée précocement. La piqûre est plus fréquemment, chez l'adulte surtout, localisée sur la moitié basse du corps.
En Europe où la maladie est plus fréquemment due à B. afzelii ou B. garinii, l'inflammation est à ce stade le plus souvent moins intense qu'en Amérique du Nord, et la croissance (migration) de l'érythème y est fréquemment plus lente. De même, selon la littérature, les patients ont fréquemment moins de symptômes systémiques[63].
A ce stade, une période de quelques heures de fièvre (fréquemment discrète, mais exceptionnellement importante) apparaît quelquefois, plus rarement accompagnée de maux de tête, d'une raideur de la nuque, d'arthralgie, de myalgie ou fatigue, ou alors de symptômes neurologiques. Une arthralgie précoce peut apparaître après la piqûre avec des douleurs qui persistent de quelques heures à quelques jours sur une ou plusieurs articulations (dont fréquemment le genou).
Le diagnostic est facilité par l'érythème migrant, mais, chez 20 % des malades, cet érythème n'apparaît pas ou est particulièrement discret.
Chez quelques-uns des autres, cette tache est accompagnée d'un fort prurit (qui peut la faire confondre avec une piqûre de moustique, d'ortie, d'araignée... ).
- La bactérie (Borrelia burgdorferi) se développe à ce stade dans la peau de l'érythème et en périphérie, comme peuvent les mettre en évidence des biopsies [64] ou la PCR[65] mais la PCR est peu efficace pour détecter la présence de la bactérie sur d'autres sites de la peau qu'elle est déjà en train de coloniser. Aux États-Unis, 65% de 118 patients ayant présenté un érythème migrant, traités par antibiotique, ont durant leurs convalescence été testés positifs pour les anticorps IgG ou IgM en réponse à B. burgdorferi et la majorité ont guéri avec le traitement antibiotique.
Stade 2 («secondaire»)
- Début de dissémination de l'infection ; de quelques jours à quelques mois après la piqure de tique
Si la lésion est passée inaperçue chez le patient (c'est le cas dans 1/3 à 50 % des diagnostics posés) ou sans antibiothérapie adaptée, une phase secondaire de la maladie peut alors apparaître, quelques semaines à quelques mois, ou alors des années après la morsure. La bactérie Borrelia déjoue le dispositif immunitaire et peut commencer à se répandre dans les fluides biologiques (dont via la circulation sanguine) et se développer dans d'autres parties du corps. Ce stade correspond à des infections tissulaires toujours focalisées (cible (s) unique ou multiples) accompagnée de manifestations neurologiques (décrites sous le nom de «neuroborréliose») et de signes rhumatologiques (décrits sous le nom d'«arthrite de Lyme») ;
Ainsi méningoradiculites douloureuses, encéphalites et encéphalomyélites forment un tableau clinique habituel, avec d'éventuelles manifestations dépressives et une fatigue chronique durant les phases de crises. Le diagnostic ne peut alors être confirmé que par l'association d'arguments cliniques, épidémiologiques et biologiques (à ce stade, l'infection active est généralement détectable dans le liquide céphalorachidien et sur les tests bactériologiques sanguins pertinents, mieux qu'en phase 3).
La neuroborréliose : Elle se traduit fréquemment en premier lieu par des méningo-radiculites, dont les symptômes sont des douleurs radiculaires avec inflammation d'un ou plusieurs nerfs crâniens, pouvant se traduire par paralysie faciale périphérique (uni ou bilatérale, de type paralysie de Bell définie par une perte de tonus musculaire d'un ou des deux côtés du visage, simulant une paralysie faciale a frigore) ) ou par une méningite lymphocytaire d'évolution prolongée et quelquefois par une méningo-myélite ou une méningo-encéphalite, mais il existe de nombreux cas atypiques (ex :rachialgie inflammatoire sans radiculite[66] ou neuropathie sensitive subaiguë [67]). La méningite est quelquefois cliniquement muette, fréquemment caractérisée par des maux de tête, une raideur de la nuque, et quelquefois par une sensibilité à la lumière. Dans tous ces cas, une ponction lombaire sert à confirmer une méningite lymphocytaire. En cas de paralysie faciale périphérique, une sérologie positive est reconnue comme suffisante pour confirmer le diagnostic et prescrire une antibiothérapie (grade C).
Des problèmes neurologiques aigus apparaissent chez 15% des patients non traités, pouvant inclure un large spectre de troubles[68]. La méningite ou un syndrome de Guillain-Barré peuvent apparaître, avec des douleurs interférant avec le sommeil, et des sensations anormales de la peau.
Les atteintes radiculaires sont en particulier sensitives. Les radiculites hyperalgiques résistent aux antalgiques habituels ainsi qu'aux anti-inflammatoires non-stéroïdiens (attention les stéroïdes sont soupçonnés de pouvoir aussi réveiller une arthrite de Lyme). Les douleurs sont fréquemment violentes et quelquefois associées à des paresthésies. Les atteintes motrices périphériques (de type paralysies asymétriques) régressent généralement (provisoirement) après six à huit semaines Le caractère organique des douleurs est questionné, car un traitement avec une bêta-lactamine a un effet spectaculaire sur ces radiculites.
Une légère encéphalite peut conduire des troubles du sommeil, de la mémoire et/ou de l'humeur (un état mental altéré a déjà été signalé comme simple et seul symptôme chez des patients en début de neuroborréliose[69]).
L'arthrite de Lyme, elle survient au moins deux mois, à plusieurs années après l'inoculation et pour des raisons toujours mal comprises touche le plus souvent en particulier et/ou en premier lieu le genou (suivi de l'épaule et du coude, statistiquement parlant).
Ces symptômes neurologiques et articulaires peuvent être accompagnés d'une fatigue chronique. Des palpitations cardiaques (trouble de conduction bénin) peuvent se produire et (plus rarement) une insuffisance cardiaque. Des vertiges peuvent aussi être induits par des changements de rythme cardiaque. On constate quelquefois (rarement) de troubles oculaires, tels qu'infiltrats cornéens parenchymateux, uvéite antérieure ou panuvéite), peut-être associée à un syndrome cardiaque sans autres symptômes repérés[70] [71]. Plus rarement d'autres manifestations peuvent apparaître (papillite, neuropathie optique ischémique antérieure aiguë (NOIAA), ou alors des paralysies oculo-motrices) ou endophtalmie. L'association de problèmes oculaires et neurologiques et/ou rhumatologiques trompe quelquefois le médecin qui pense faire face à d'autres maladies (Behçet, sarcoïdose par exemple).
Des névralgies peuvent apparaître et un cas de difficultés respiratoires lié à une paralysie du diaphragme a été signalé [72]
Un traitement adapté induit le plus souvent à ce stade une réponse positive.
Stade 3 (ou «tertiaire»)
- Généralisation tardive de l'infection
À ce stade, le lien entre les symptômes et l'infection d'origine est moins évident. Le médecin a fréquemment plus de présomption que de certitude, mais le peu d'efficacité des anti-inflammatoires associée à un progrès rapide de l'état du patient sous antibiotique plaide en faveur du diagnostic.
Après quelques mois ou années, certains patients non traités ou insuffisamment traités voient tout ou partie des symptômes qui ont précédé s'aggraver et pour certains prendre un caractère chronique. De nombreux organes peuvent alors être touchés, dont les nerfs, les yeux, les tendons, les articulations, les muscles (ex : amyotrophie invalidante [73]), dont le cœur ou même la rate[74].
Les phénomènes inflammatoires et/ou dysimmunitaires incluent fréquemment des symptômes neurologiques (on parle alors de «neuroborréliose tardive» ; qui regroupe des encéphalomyélites chroniques et polyneuropathies sensitives axonales distales, et encéphalopathies tardives, le plus souvent associées à des anomalies du liquide céphalo-rachidien (LCR) ; avec synthèse d'anticorps spécifiques dans le LCR (grade C) ). 5 % des patients non traités sont alors victimes de symptômes neurologiques chroniques[75] ; La polyneuropathie se manifeste en premier lieu avec des pics de douleurs, quelquefois accompagnés d'engourdissements et picotements dans les mains ou les pieds. Un syndrome neurologique quelquefois nommé «encéphalopathie de Lyme» est associée à de subtils problèmes cognitifs tels que difficultés de concentration et perte de mémoire du court terme.
Une Encéphalomyélite chronique peut s'installer progressivement avec par exemple des troubles cognitifs, une faiblesse musculaire des jambes, gênant la marche, une paralysie faciale, des problèmes de vessie, des vertiges, et des maux de dos, des paraparésies spastiques et/ou une myélite faisant évoquer une sclérose en plaques
- Ces patients peuvent aussi ressentir une profonde fatigue[76].
- La dépression et la fibromyalgie peuvent survenir, mais ne sont pas plus habituelles chez les personnes qui ont été infectées par Lyme que dans la population générale. [77] [78]
- Rarement, une psychose a été reconnue comme induite par une maladie de Lyme chronique (des erreurs de diagnostic de schizophrénie et de trouble bipolaire sont envisageables). Des crises de panique et d'anxiété peuvent se produire, avec quelquefois un comportement délirant, délire somatoforme quelquefois accompagné d'un syndrome de dépersonnalisation ou déréalisation comparable à ce qui a été vu dans le passé aux premiers stades prodromiques ou de parésie générale. [79] [80];
L'Arthrite de Lyme peut à ce stade (ré) apparaître et s'aggraver (plus douloureuse et en séquences de plus en plus longues). Elle affecte classiquement les genoux (la radiographie y montre une hypertrophie synoviale et quelquefois un épanchement), mais chez une minorité de patients atteints, elle peut toucher d'autres articulations dont la cheville, les coudes, les poignets, hanches et épaules). La douleur est fréquemment légère ou modérée, fréquemment avec un gonflement de l'articulation en cause. Des kystes de Baker (ou Bursite poplitée) peuvent exister dans ces articulations, et crever en libérant leur contenu. Occasionnellemen, une érosion osseuse est observée.
L'Acrodermatite chronique atrophiante (ou ACA jadis aussi appelée «maladie de Pick-Herxheimer») est le symptôme le plus net, mais il n'est essentiellement observée qu'en Europe et pas chez l'ensemble des patients [81]. L'ACA débute avec un changement de couleur et de texture d'une surface de peau, généralement sur une région exposées au soleil des membres supérieurs ou inférieurs. L'atrophie se traduit par des surfaces de peau qui deviennent particulièrement fines et transparentes, prenant une apparence rappelant un papier froissé de cigarette et une couleur rouge à violacée, avec quelquefois l'apparence de certains lichens plan. L'ACA en premier lieu située peut ensuite s'étendre progressivement et quelquefois se bilatéraliser.
Des symptômes évoquant une dermatomyosite peuvent aussi apparaître, induits par B Burgdorferi [82]. Cette acrodermatite pourrait n'être induite que par certaines borrélies européennes ou nord-asiatiques, dont Borrelia afzelii et certainement d'autres borrélies (Borrelia garinii a déjà été détectée chez des patients présentant une ACA) en Europe.
Un Lymphocytome cutané bénin peut apparaître, le plus souvent sur le lobe de l'oreille ou sous forme de nodule rouge à violacé, de 1 à 2 cm de diamètre. Il peut aussi apparaitre sur le visage ou le thorax en prenant quelquefois un aspect tumoral, lupoïde à la vitro-pression.
Complications cardiaques : elles sont habituelles à ce stade, quoiqu'apparemment plus rares avec les borrélioses européennes que nord-américaines : il s'agit fréquemment d'une inflammations du cœur, de myocardite ou des arythmies) liés à des problèmes de conduction touchant les blocs auriculo-ventriculaire, sino-auriculaires ou intra-ventriculaires, et plus rarement des péricardites ou des myocardites. Un électrocardiogramme doit par conséquent être systématique chez les patients victimes de la maladie, car une défaillance cardiaque (arrêt cardiaque, syncope) s'avère quelquefois mortelle chez ces patients.
Soins, traitement
Si la tique est retirée de la peau dans les 36 premières heures après qu'elle s'y est fixée, les risques de contamination sont connus faibles ; inférieurs à 1 %, car les borrelia ne sont à ce moment pas encore dans les glandes salivaires de la tique mais dans son tube digestif. Pour infecter l'hôte, elles doivent toujours migrer du tube digestif aux glandes salivaires, ce qui demanderait 2 à 3 jours.
La tique doit par conséquent être retirée le plus rapidement envisageable, et en minimisant les risques de régurgitation de celle-ci, c'est-à-dire sans l'écraser.
Il n'est plus recommandé d'utiliser des produits tels que l'éther. Divers modèles de pince spéciales ou de sortes de petits pieds de biche sont commercialisés en pharmacie (avec un modèle plus petit pour les larves et nymphes). Ils permettent d'extraire les tiques (en les tournant doucement dans le sens INVERSE des aiguilles d'une montre[83] Ce «dévissage» permet d'extraire sans peine la tique, au moins si elle n'est pas ancrée depuis trop longtemps. Il évite de risquer de laisser le rostre ou la tête et son cément fichés dans la peau, ce qui peut provoquer une infection, ou alors un abcès.
La plaie doit ensuite être désinfectée. Le traitement antibiotique doit être prescrit par un médecin si une tache rouge grandit autour de la piqûre (érythème migrant) ou si des symptômes tels que fièvre ou syndrome grippal apparaissent dans les jours ou semaines suivantes. Il arrive que le traitement n'éradique pas les borrélies. Weber et ses collègues concluaient en 1996 que «La plupart, sinon l'ensemble des antibiotiques utilisés à ce jour ont été associés à un échec du traitement chez les patients atteints d'érythème migrant». [84], qui peuvent alors induire la seconde phase de la maladie. La naissance d'arthrite ou de troubles neurologiques ou d'une méningite, associés à une augmentation des anticorps contre une borrélie doit alors alerter le patient et le médecin qui peut prescrire un traitement plus long.
Traitement médicamenteux
La grande majorité des infections soignées au premier stade sont guéries par les antibiotiques recommandés ; la pénicilline ou les cyclines forment à l'heure actuelle l'unique traitement de la maladie de Lyme. En phase primaire (généralement repérée suite à un érythème migrant, l'amoxicilline, la doxycycline ou le cefuroxime axetil doivent être prescrits durant 10 à 14 jours, au plus tôt (dans les 72 heures si envisageable) pour éviter les séquelles cardiaques.
Les céphalosporines de troisième génération ou la doxycycline, du ceftriaxone sont indiqués au stade secondaire ou tertiaire pour une durée d'au moins 28 jours et jusqu'à 6 semaines selon certains auteurs[85] [86].
La voie intraveineuse est obligatoire en cas de méningite ou d'encéphalite ; l'antibiotique est alors délivré par un cathéter veineux ventral périphérique (PICC pour les anglophones).
Les patients victimes d'autres manifestations ou séquelle grave de la maladie de Lyme seront traités selon leur condition clinique, sous le contrôle d'un spécialiste.
Pronostic
Une petite partie des borrélies peuvent survivre aux antibiotiques en se protégeant dans une forme «cystique». Elles entretiennent ainsi une infection latente (d'où le caractère récurrent des symptômes de borrélioses). Un patient ne peut par conséquent jamais être reconnu comme guéri avec certitude, même après un long traitement antibiotique.
Tout patient dont les tests montrent la persistance d'anticorps à une borrélie responsable de ML, même sans signes cliniques d'infection, doit être suivi et faire peut-être l'objet d'un nouveau traitement en cas de réapparition de symptômes.
Ayant constaté de spectaculaires améliorations des symptômes dès le début des antibiothérapies, on a en premier lieu cru que les antibiotiques adaptés étaient toujours efficaces, mais de nombreux patients, quelques semaines, mois ou années après leur traitement font des rechutes (à leur tour au moins provisoirement atténuées par le traitement antibiotique) [87]. Les premiers retours d'expérience ont montré que des rechutes sont envisageables (sans réinfection), des mois ou des années après une apparente guérison ou après une nette amélioration [46].
En particulier, plusieurs expériences sur des animaux (chiens, poneys.. ) ont confirmé que des borrélies pouvaient résister aux antibiotiques jadis connus pouvoir les éradiquer.
Elles survivent certainement dans des organes ou parties d'organes moins accessibles au dispositif immunitaire ainsi qu'aux molécules antibiotiques (par exemple dans l'humeur vitreuse ou dans son enveloppe [88]) ou dans certaine zones fibreuses ou de collagène des tissus conjonctifs (membranes synoviales par exemple) ou dans les fibroblastes, ce qui a été confirmé par diverses observations au microscope optique ou électronique montrant une persistance de spirochètes vivants dans des tissus conjonctifs synoviaux profonds (où on a aussi détecté leurs antigènes) chez des malades chroniques traités une ou plusieurs fois. " Si des spirochètes sont déjà piégés dans un tissu qui est inaccessible aux antibiotiques par exemple dans le fibrineux et le collagène des tissus ou dans les fibroblastes, une forte dose parentérale d'antibiotiques, ou une combinaison de thérapies de longue durée mai sont nécessaires pour éliminer les spirochètes ".
En 1996, Mursic et ses collègues concluaient déjà en 1996 [89] à la persistance clinique de B. burgdorferi chez des patients ayant développé une borrélios de Lyme, malgré une antibiothérapie jugée adaptée. Chez ces patients, des borrélies vivantes ont été trouvées dans des biopsies de fluide cerébrospinal, de peau, de l'œil, du cœur et des articulations. Les auteurs pensent, selon étude in vitro de formes atypiques de la bactérie (cystes surtout) que les Borrélies peuvent sous certaines formes survivre à une antibiothérapie qui était jugée adaptée et opportune.
L'infection semble se poursuivre à bas bruit au point d'échapper aux tests sérologiques. La même année une autre étude (randomisée, en double aveugle) [90] concluait à de habituels échecs de l'antibiothérapie, les auteurs ajoutant, que «Cinquante-sept pour cent des patients qui avaient une rechute étaient séronégatifs au moment de la rechute».
Toujours en 1996, une autre étude[91] a porté sur 97 patients testés après un traitement antibiotique pour un érythème migrant : dans 74, 2% des cas, la PCR détectait toujours dans leur urine des traces de l'ADN de B. burgdorferi, en dépit d'un traitement qui avait duré au moins 3 semaines et jusqu'à 2 mois, par voie orale ou intraveineuse. Chez 4 de ces patients, les résultats de PCR ont en premier lieu été négatifs (après le traitement) pour redevenir positifs 4 à 6 semaines plus tard. Tous ces patients continuaient à ressentir des symptômes identiques à ceux de la maladie de Lyme, fréquemment aggravés... Les auteurs ont noté que la majorité des patients de cette étude après quelques mois sans antibiotiques ont à nouveau développé des symptômes neurologiques et d'arthrite, avec une intensité croissante, de sorte que le traitement a été repris. "
En 1998, une étude de 4 malades continuant à éprouver des douleurs articulaires après une antibiothérapie démontrait la présence de borrélies dans leurs membranes synoviales tandis qu'on ne les détectait plus par PCR ; ni dans le liquide synovial, ni dans les urines de ces patients [92].
Que dit le modèle animal ?
À la fin des années 1990, des chercheurs ont montré [93], dans 3 expériences différentes, que des chiens infectés par des borrélia burgdorferi traités 30 jours par différents antibiotiques (amoxicilline; azithromycine; ceftriaxone; doxycycline) voyaient leurs symptômes d'arthrite aiguë disparaitre, mais que ces traitements échouaient à éliminer la bactérie de leur organisme. «B. burgdorferi migre et se dissémine dans différents tissus après avoir été inoculée par la tique. Elle cause des épisodes aigus d'arthrite et une infection persistante. Le spirochète survit à un traitement antibiotique et la maladie peut être réactivée chez l'animal immunitairement déprimé» ont conclu les auteurs.
Une autre expérience a consisté à faire piquer par des tiques porteuse de Borrelia burgdorferi des chiens de laboratoire «specific-pathogen-free» autrement dit dépourvus d'infection microbienne. Six de ces chiens ont été traités par de fortes doses de doxycycline et 5 par de fortes doses d'amoxicilline, durant 30 jours. Les symptômes ont été prévenus ou ont été particulièrement perfectionnés chez l'ensemble des chiens sauf l'un de ceux traité par doxycycline, mais une infection persistante a néanmoins été détectée à l'autopsie 6 mois après (B. burdorferi a été détecté par PCR sur biopsie de peau et de tissus chez 6 de ces chiens apparemment guéris, mais maintenus 6 mois en isolement. «Après la fin du traitement antibiotique, les niveaux d'anticorps commencent à remonter, certainement en réponse à une nouvelle prolifération des survivants du pool précédent de spirochètes» ont conclu les auteurs[94].
Deux autres études[95] ont montré que ni l'amoxicilline ni la doxycycline administrées pendant 30 jours n'avaient réussi à éliminer une infection persistante (sur 11 chiens) ; Juste après le traitement, les borrelies n'étaient plus détectables et le taux d'anticorps avait diminué, et les lésions avaient été évitées ou apparemment guéries. Mais des spirochètes ont cependant survécu dans les tissus d'au moins trois de ces chiens, tandis que le taux d'anticorps remontait et que de l'ADN de B. burgdorferi était à nouveau détecté par les tests 6 mois après le traitement. " Les auteurs précisent qu'ils ont détecté (par la culture et par PCR) B. burgdorferi fiablement dans la peau, mais rarement dans le sang de ces animaux. Ils en ont trouvé dans les membranes synoviale des articulations, mais non dans le liquide synovial, et dans les méninges, mais non dans le liquide céphalo-rachidien (LCR) où on les cherche généralement.
Séquelles et «syndrome post-BL»
Certains patients, quoiqu'ayant suivi leur traitement antibiotique continuent à manifester une fatigue sévère, des douleurs, des troubles du sommeil et des difficultés cognitives. Un débat existe sur l'opportunité ou non dans ce cas de poursuivre un traitement antibiotique (qui semble quelquefois avoir peu d'effets durables, ou alors peu d'effet sur ces symptômes, mais qui a des effets secondaires). Il semble aussi que le traitement augmente provisoirement les douleurs de certains patients et les complications résultant d'atteintes articulaires et/ou neurologiques, peuvent ne régresser que particulièrement lentement ou alors chez certains patients perdurer durablement ou sous forme de rechutes (dont les symptômes sont perfectionnés par les antibiotiques) [16] ou la maladie est réactivée à l'occasion de stress ou baisse de l'immunité.
Chez les malades traités en phase II ou III, des troubles du sommeil et des difficultés cognitives persistent fréquemment malgré et après le traitement antibiotique. Dans les années 1990, des groupes de patients et certains médecins ont observé qu'une phase "chronique" de la maladie pouvait être responsable d'une gamme de symptômes toujours médicalement inexpliqués, mais objectivement constatés après la fin des manifestations attendues de la maladie.
Il n'y a pas de consensus sur l'attitude à observer : Certains estiment qu'une antibiothérapie longue est indispensable dans ces cas [96], mais parmi 4 études basées sur des essais contrôlés (randomized controlled trials) de longue durée de traitements antibiotiques prolongés dans des cas de symptômes persistants ;
- - deux n'y ont trouvé aucun avantage [97], [98]
- - et les deux autres ont conclu à des avantages incompatibles avec leurs effets secondaires importants ou avec les risques induits par un traitement antibiotique prolongé [99] [100] [101] [102] [103].
Prévention, précautions
Les mesures fréquemment proposées sont :
- porter en forêt des habits couvrants (pantalon enfilé dans chaussettes)
- s'inspecter attentivement durant et après les promenades ou le travail en forêt
- utilisation de répulsifs à tiques dans les zones à risque (insectifuge contenant 20% - 30% de DEET (N, N-diéthyl-m-toluamide) à pulvériser sur la peau exposée et les vêtements) ;
- dans quelques cas l'utilisation préventive d'acaricide a été proposée, mais avec le risque d'induire une sélection de tiques résistantes à ces insecticides et d'intoxiquer les enfants qui jouent sur les sites ainsi traités ou les animaux qui s'y nourriront.
- l'abondance des tiques pourrait être réduite dans certaines zones (parcs et jardins périforestiers... ) par une zone-tampon dépourvue de litière de feuilles mortes (par exemple garnie de mulch ou de gravier entre la lisière forestière et les zones de jeu d'enfant, de pique nique, etc. ) et par des mesures interdisant l'intrusion d'animaux tels que sangliers ou cervidés (recommandation CDC selon Piesman et al [104] et Ginsberg et al. [105]).
- Le US CDC recommande la prescription d'une dose unique de doxycycline pour prophylaxie de la maladie de Lyme chez toute personne de plus de 8 ans ayant été mordue par une nymphe ou adulte de I. scapularis et I. pacificus, si la zone est localisée parmi celles où on estime qu'au moins 20% des tiques infectées par Borrelia burgdorferi. Si la tique est restée attachée 36 heures ou plus. La prophylaxie antibiotique doit être administrée dans les 72 heures après l'enlèvement de la tique[106].
Vaccin
Il existait un vaccin aux États-Unis mais non efficace pour les bactéries européennes et retiré du marché après avoir génèré plus d'un millier de cas d'arthrites inguérissables. En zone à risque, des vaccins concernant d'autres maladies à tiques peuvent cependant limiter le risque de co-infection.
Incertitudes
Malgré des progrès sensibles, il est envisageable que les tests disponibles ne repèrent pas forcément les borrélies, et ils pourraient ne pas repérer l'ensemble des variantes du parasite.
Les causes de l'extension de la maladie ne sont certainement pas toutes connues.
Une maladie de Lyme peut aussi se compliquer de co-infections aggravantes et/ou perturbant le diagnostic, aussi transmises par les tiques, comme les rickettsioses[107], les ehrlichioses [108], la babésiose [109], la bartonellose, les infections à mycoplasmes. Ces co-infections doivent alors elles aussi être traitées.
Les tests répétés dans le temps montrent que le dispositif immunitaire devient plus précis dans sa réaction au fur et à mesure que le temps passe, mais un malade, même guéri ou apparemment guéri, n'est pas immunisé : la réinfection d'un même patient est envisageable[110] [111].
D'autre part, chez des patients ayant développé une allergie à la salive de tique, une piqûre peut réactiver un prurit ou des érythèmes sur les sites d'anciennes piqûres (antérieures de plus de 10 ans quelquefois). Des allergies croisées avec d'autres allergènes semblent envisageables.
Notes et références
- ↑ Steere, A. C., T. F. Broderick, and S. E. Malawista. 1978. Erythema chronicum migrans and Lyme arthritis : epidemiologic evidence for a tick vector. Am J Epidemiol 108 :312-321.
- ↑ Steere, A. C., S. E. Malawista, J. A. Hardin, S. Ruddy, W. Askenase, and W. A. Andiman. 1977. Erythema chronicum migrans and Lyme arthritis. The enlarging clinical spectrum. Ann Intern Med 86 :685-698.
- ↑ Steere, A. C., S. E. Malawista, D. R. Snydman, R. E. Shope, W. A. Andiman, M. R. Ross, and F. M. Steele. 1977. Lyme arthritis : an epidemic of oligoarticular arthritis in children and adults in three connecticut communities. Arthritis Rheum 20 :7-17
- ↑ MM. Ch. Garin et Bujadoux, Paralysie par les Tiques. in Le journal de médecine de Lyon 1922, 71, 765
- ↑ Nuttal, «Tick paralysis» ; in Man and animals Parasitology, vol. VII, n° 1, may 14, 1914, p. 95
- ↑ Hawden, «Tick paralysis» in Sheep and man following bites of Dermaceutor venustus. Parasitology, vol. VI, 1913, p. 283-297., avec bibliographie d'auteurs antérieurs à la page 297.
- ↑ C. Strickland, Note on a case of Tick Paralysis in Australia. Parasitology, vol. VII, p. 379, 1915
- Burgdorfer W, Barbour AG, Hayes SF, Benach JL, Grunwaldt E, Davis JP. Lyme disease ; a tick-limite spirochetosis ? Science 1982;216 :1317-9.
- ↑ Barbour, A. G. 1984. Isolation and cultivation of Lyme disease spirochetes. Yale J Biol Med57 :521-525.
- ↑ Barbour, A. G., W. Burgdorfer, S. F. Hayes, O. Péter, and A. Æschlimann. 1983. Isolation of a cultivable spirochete from Ixodes ricinus ticks of Switzerland. Current Microbiology 8 :123- 126.
- ↑ Burgdorfer, W., A. G. Barbour, S. F. Hayes, O. Peter, and A. Æschlimann. 1983. Erythema chronicum migrans--a ticklimite spirochetosis. Acta Trop 40 :79-83.
- ↑ Johnson, R. C., F. W. Hyde, G. P. Schmid, and D. J. Brenner. 1984. Borrelia burgdorferi sp. nov. : etiological agent of Lyme disease. Int J Syst Bacteriol 34 :496-497.
- ↑ Benach JL, Bosler EM, Hanrahan JP, et al. Spirochetes isolated from the blood of two patients with Lyme disease. N Engl J Med 1983;308 :740--2.
- ↑ Steere AC, Grodzicki RL, Kornblatt AN, et al. The spirochetal etiology of Lyme disease. N Engl J Med 1983;308 :733--40
- ↑ Dennis DT, Piesman, JF. Overview of tick-limite infections in humans. In : Goodman JL, Dennis DT, Sonenshine DE, eds. Tick-limite infections of humans. Washington, DC : ASM Press; 2005.
- "Borréliose de Lyme 1ère partie : épidémiologie et diagnostic GuideLine" (Revue Médicale Suisse, 5 avril 2006)
- ↑ Ryan KJ, Ray CG ; Sherris Medical Microbiology ; 4ème edition (page 434-437) Ed : McGraw Hill ;2004 ;ISBN :00838585299
- ↑ Creapharma (Suisse)
- ↑ Pichon B, Rogers M, Egan D, Gray J. (Université de Dublin) Blood-meal analysis for the identification of reservoir hosts of tick-limite pathogens in Ireland; Vector Limite Zoonotic Dis. 2005 Summer;5 (2) :172-80 (PMID : 16011434) Résumé (en Anglais)
- ↑ Johnson RC ; Baron's Medical Microbiology ; Editeurs SBaronet al. 4ème édition, Univ of Texas Medical Branch (chapitre : Borrelia), 1996 Voir ; ISBN :0-9631172-1-1
- ↑ Transmission des maladies vectorielles à tiques à l'enfant lors de la grossesse sur http ://www. lymeinfo. net
- ↑ Transmission de la maladie de Lyme sur le site du CDC
- ↑ B. Gilot, B. Degeilh, J. Pichot, B. Doche et C. Guiguen. (1996). Prevalence of Borrelia burgdorferi (sensu lato) in Ixodes ricinus (L. ) populations in France, according to a phytœcological zoning of the territory. In Eur. J. Epidemiol. 395-401, p. 395-401.
- Fikrig E, Narasimhan S Borrelia burgdorferi--traveling incognito? Microbes Infect. ; volume = 8 ; issue = 5 ; pages = 1390-9 ; Avril 2006 PMID :16698304 doi :10.1016/j. micinf. 2005.12.022, Résumé
- ↑ Xu Q, Seemanapalli SV, Reif KE, Brown CR, Liang FT ; Increasing the recruitment of neutrophils to the site of infection dramatically attenuates Borrelia burgdorferi infectivity ; journal : J. Immunol. ; volume=178 ; issue=8 ; pages=5109–15 ; Avril 2007 ; pmid :17404293 ; Voir
- ↑ Coleman JL, Gebbia JA, Piesman J, Degen JL, Bugge TH, Benach JL ; Plasminogen is required for efficient dissemination of B. burgdorferi in ticks and for enhancement of spirochetemia in mice Cell (journal) ; volume = 89 ; issue = 7 ; pages 1111-9 ; Juin 1997 ; PMID :9215633 [http ://linkinghub. elsevier. com/retrieve/pii/S0092-8674 (00) 80298-6) DOI)
- ↑ de Silva AM, Telford SR 3rd, Brunet LR, Barthold SW, Fikrig E. ; 1996 ; Borrelia burgdorferi OspA is an arthropod-specific transmission-blocking Lyme disease vaccine. ; J Exp Med. 1996 Jan 1;183 (1) :271-5.
- ↑ Rendi Murphree Bacon, MS, Kiersten J. Kugeler, MPH, Paul S. Mead, MD Surveillance for Lyme Disease --- United States, 1992--2006 Résumé du rapport MMWR October 3, 2008
- ↑ Æschlimann A, Chamot E, Gigon F, Jeanneret JP, Kesseler D, Walther C. B. burgdorferi in Switzerland. Zentralbl Bakteriol Mikrobiol Hyg (A) 1987;263 :450-8.
- ↑ Jouda F, Perret JL, Gern L. Density of questing Ixodes ricinus nymphs and adults infected by Borrelia burgdorferi sensu lato in Switzerland : Spatio-temporal pattern at a regional scale. Vector Limite Zoonotic Dis 2004; 4 :23-32.
- ↑ F. CHRISTIANN, P. RAYET, 0. PATEY AND C. LAFAIX. (1996) Epidemiology of Lyme Disease in France - Lyme Borreliosis in the region of Berry Sud - A six year retrospective. In Europ. J. Epidemiol., p. 479-483.
- Caroline Burri, Francisca Moran Cadenas, Veronique Douet, Jacqueline Moret, Lise Gern. Ixodes ricinus Density And Infection Prevalence of Borrelia burgdorferi Sensu Lato Along A North-Facing Altitudinal Gradient in The Rhône Valley (Switzerland) Vector-Limite and Zoonotic Diseases. Spring 2007, 7 (1) : 50-58. doi :10.1089/vbz. 2006.0569 (Article OnLine)
- ↑ Nahimana I, Gern L, Peter O, Praz G, Moosmann Y, Francioli P. Epidemiology of Lyme borreliosis in Frenchspeaking Switzerland. Schweiz Med Wochenschr 2000; 130 :1456-61
- ↑ Fahrer H, van der Linden SM, Sauvain MJ, Gern L, Zhioua E, Æschlimann A. The prevalence and incidence of clinical and asymptomatic Lyme borreliosis in a population at risk. J Infect Dis 1991 ;163 :305-10.
- ↑ Zhioua E, Gern L, Æschlimann A, Sauvain MJ, Van der LS, Fahrer H. Longitudinal study of Lyme borreliosis in a high risk population in Switzerland. Parasite 1998;5 :383-6.
- ↑ Steere AC, Taylor E, McHugh GL, Logigian EL. The overdiagnosis of Lyme disease. JAMA 1993;269 :1812--6.
- ↑ Elston, D. A., Moss, R., Boulinier, T., Arrowsmith, C. et Lambin, X. (2001). Analysis of aggregation, a worked example : numbers of ticks on red grouse chicks. Parasitology 122, 563-569.
- ↑ Pérez-Eid, C. (2007). Les tiques. Identification, biologie, importance médicale et vétérinaire, Paris : Lavoisier, 314 p.
- ↑ Stephen E. Malawista1 et Anne de Boisfleury Chevance ; Clocking the Lyme Spirochete ; PLoS ONE. 2008; 3 (2) : e1633. ; Mis en ligne le 20 février 2008 ;DOI :10.1371/journal. pone. 0001633. Lire l'étude en ligne (PubMed) (Licence Creative Commons)
- ↑ Goldstein, SF; Charon, NW; Kreiling, JA. Borrelia burgdorferi swims with a planar waveform similar to that of eukaryotic flagella. Proc Natl Acad Sci U S A. 1994;91 :3433–7
- ↑ Kimsey, RB; Spielman, A. Motility of Lyme disease spirochetes in fluids as viscous as the extracellular matrix. J Infect Dis. 1990;162 :1205–8. Résumé PubMed
- ↑ Li, C; Motaleb, A; Sal, M; Goldstein, SF; Charon, NW. Spirochete periplasmic flagella and motility. J Mol Microbiol Biotechnol. 2000;2 :345–54. Résumé (PubMed)
- ↑ Charon, NW; Goldstein, SF. Genetics of motility and chemotaxis of a fascinating group of bacteria : the spirochetes. Annu Rev Genet. 2002;36 :47–73. résumé (PubMed)
- ↑ Breier F et al. ; 2001 Isolation and polymerase chain reaction typing of Borrelia afzelii from a skin lesion in a seronegative patient with generalized ulcerating bullous lichen sclerosus et atrophicus. Br J Dermatol, 144 (2) :387-392.
- ↑ Branigan P; Rao J; Rao J; Gerard H; Hudson A; Williams W; Arayssi T; Pando ; J; Bayer M; Rothfuss S; Clayburne G; Sieck M; Schumacher HR ; 1997 ; PCR evidence for Borrelia burgdorferi DNA in synovium in absence of positive serology. American College of Rheumatology, Vol 40 (9) Suppl, Sept, p. S270
- Kufko IT; et al. ; 1999 Comparative study of results of serological diagnosis of Lyme borreliosis by indirect immunofluorescence and immunœnzyme analysis ; Klin Lab Diagn, 3 :34-7
- ↑ Steere AC. Lyme disease. N Engl J Med 1989;321 : 586-96.
- ↑ Steere AC, Broderick TF, Malawista SE. Erythema chronicum migrans and Lyme arthritis : epidemiologic evidence for a tick vector. Am J Epidemiol. 1978 Oct; 108 (4) : 312-321 (Résumé)
- ↑ Dournon E, Assous M, Candalot B. La maladie de Lyme, In : Encycl Med Chir. (Paris, France), C. P. Hématologie-Infections, 2682, 4.11.12, 4p
- ↑ Hengge UR, Tannapfel A, Tyring SK, Erbel R, Arendt G, Ruzicka T. Lyme borreliosis. Lancet Infect Dis 2003;3 :489-500.
- ↑ Cimperman J et al ; 1999 Lyme meningitis : a one-year follow up controlled study. Wien Klin Wochenschr, 111 (22-23) :961-3 ; (Résumé : “The results of our study revealed that Lyme meningitis frequently occurs without meningeal signs and is often accompanied by additional Ruzic-Sabljic E; borreliosis persisted or occurred for the first time in several patients. They were not infrequent even at the examination performed one year after therapy. ”)
- ↑ Decision support for diagnosis of lyme disease, consulté 2008-10-03 (NIH, en Anglais)
- ↑ Krause, PJ, Telford, SR, Spielman, A, et . al. Concurrent Lyme disease and Babesiosis. JAMA 1996.275 (21) :1657
- ↑ Exemple de rash
- ↑ Cairns V, Godwin J ; Post-Lyme borreliosis syndrome : une méta-analyse des symptômes ; Int J Epidemiol ; volume = 34 (pages = 1340-1345) ; 2005 ; PMID :16040645 | doi :10.1093/ije/dyi129
- ↑ Edlow JA ; La maladie de Lyme (eMedicine) ; 2007-01-25, consulté 2007-08-21
- ↑ Steere AC, Sikand VK, Schœn RT, Nowakowski J. ;Asymptomatic infection with Borrelia burgdorferi. ; Clin Infect Dis. 2003 Aug 15;37 (4) :528-32. Epub 2003 Jul 30 ; PMID :12905137
- ↑ Steere AC, Sikand VK, Schœn RT, Nowakowski J Infections asymptomatiques par Borrelia burgdorferi ; Journal = Clin. Infect. Dis. Vol 37, N° 4, pages 528-532, 2003 ; PMID :12905137, DOI :10.1086/376914
- ↑ Fahrer H, Sauvain MJ, Zhioua E, Van Hœcke C, le Gern Longterm survey (7 years) in a population at risk for Lyme borreliosis : what happens to the seropositive individuals? (Étude à long terme, sur la séropositivité, conduite sur 7 ans, dans une population à risque de la borréliose de Lyme) ; Journal = Eur. J. Epidemiol ; volume 14, Issue 2, Pages 117-123 ; 1998 ; PMID :9556169
- ↑ Dobracki W, Dobracka B, Paczosa W, Zieba J, Bereś P. ; Epidemiology of borreliosis in workers of the district forestry offices in Lower Silesia ; Przegl Epidemiol. 2007;61 (2) :385-91. (article en polonais, avec résumé en anglais, consulté 2009 05 21)
- ↑ Fauci, Anthony S. (2008). Harrison's Principles of Internal Medicine : Editors, Anthony S. Fauci... [Et Al. ]. McGraw-Hill Medical Publishing. chapitre 166 (ISBN 0-07-159991-6) .
- ↑ Smith RP, Schœn RT, Rahn DW, Sikand VK, Nowakowski J, Parenti DL, Holman MS, Persing DH, Steere AC (March 2002) ; Clinical characteristics and treatment outcome of early Lyme disease in patients with microbiologically confirmed erythema migrans; Ann. Intern. Med. 136 (6) : 421–428. PMID :11900494 (voir surtout la Fig 3)
- ↑ Strle F, Nadelman RB, Cimperman J, Nowakowski J, Picken RN, Schwartz I, et al. Comparison of culture-confirmed erythema migrans caused by Borrelia burgdorferi sensu stricto in New York State and by Borrelia afzelii in Slovenia. Ann Intern Med. 1999;130 :32-6. [PMID : 9890847]
- ↑ Berger BW, Johnson RC, Kodner C, Coleman L. Cultivation of Borrelia burgdorferi from erythema migrans lesions and perilesional skin. J Clin Microbiol. 1992;30 :359-61. ; PMID : 1537904
- ↑ Melchers W, Meis J, Rosa P, Claas E, Nohlmans L, Koopman R, et al. Augmentcation of Borrelia burgdorferi DNA in skin biopsies from patients with Lyme disease. J Clin Microbiol. 1991;29 :2401-6. ; PMID :1774243
- ↑ Séverine Chanier, Michel Lauxerois et Virginie Rieu ; Rachialgies sans radiculite révélant une maladie de Lyme : À propos de deux cas (Back pain without radiculitis as an d'origine manifestation of Lyme disease; Two cases) ; La Presse Médicale ; Volume 36, Issue 1, Part 1, January 2007, Pages 61-63
- ↑ E. Thouvenot, K. Hadjout, S. Grosleron, J. M. Blard et M. Pagès, Neuropathie sensitive ataxiante et maladie de Lyme (Ataxic sensory neuropathy and Lyme disease) ; Revue Neurologique Volume 160, Issues 8-9, September 2004, Pages 833-835 ; DOI :10.1016/S0035-3787 (04) 71040-1
- ↑ Auwærter PG, Aucott J, Dumler JS (January 2004). Lyme borreliosis (Lyme disease) : molecular and cellular pathobiology and prospects for prevention, diagnosis and treatment. Expert Rev Mol Med 6 (2) : 1–22. ; DOI :10.1017/S1462399404007276 ; PMID :14987414
- ↑ Chabria SB, Lawrason J (2007). Altered mental status, an unusual manifestation of early disseminated Lyme disease : A case report. Journal of Medical Case Reports 1 (1) : 62. ; DOI :10.1186/1752-1947-1-62 : PMID :17688693
- ↑ Ex : cardiomyopathie dilatée et arythmogène sévère associé à une panuvéite : J. Deibener C. De Chillou, K. Angioi, T. Maalouf et P. Kaminsky ; Cardiomyopathie dilatée et panuvéite bilatérale révélant une maladie de Lyme. Revue générale à propos d'un cas (Cardiomyopathy and panuveitis as presenting symptoms of Lyme disease. Review of one case), Éditions scientifiques et médicales Elsevier SAS ; DOI :10.1016/S0248-8663 (00) 00287-3, online 15 janvier 2001, consulté 2008 02 19
- ↑ B. Kadz, A. Puttemana, C. Verougstrætea, L. Caspersa ; La maladie de Lyme du point de vue de l'ophtalmologue (Lyme disease from an ophthalmological point of view Journal Français d'Ophtalmologie) ; Volume 28, Issue 2, February 2005, Pages 218-223, DOI :10.1016/S0181-5512 (05) 81046-0 ; On line 13 November 2007.
- ↑ Faul JL, Ruoss SJ, Doyle RL, et al. Diaphragmatic paralysis due to Lyme disease. Eur Respir J. 1999; 13 :700 -702
- ↑ M Kianzowa, O Saraceni, J. M. Wilhelm and P Kieffe ; Maladie de lyme révélée par une amyotrophie invalidante (Lyme disease revealed by serious amyotrophy) ; La Revue de Médecine Interne ; Volume 14, Issue 7, 1993, Pages 723-726 ; DOI :10.1016/S0248-8663 (05) 81238-X
- ↑ Cimmino MA, Azzolini A, Tobia F, Pesce Cm. Spirochète dans la rate d'un patient présentant la maladie de Lyme chronique. Amer J Clin Pathol 1989;91 :95-7
- ↑ Fahrer H, Sauvain MJ, Zhioua E, Van Hœcke C, Gern LE. Longterm survey (7 years) in a population at risk for Lyme borreliosis : What happens to the seropositive individuals ? Eur J Epidemiol 1998;14 :117-23.
- ↑ Ostrov BE, Athreya BH. Lyme disease. Difficulties in diagnosis and management. Pediatr Clin North Am 1991; 38 :535-53
- ↑ Kaiser R. False-negative serology in patients with neuroborreliosis and the value of employing of different borrelial strains in serological assays. J Med Microbiol 2000;49 :911-5.
- ↑ Ostrov BE, Athreya BH. Lyme disease. Difficulties in diagnosis and management. Pediatr Clin North Am 1991; 38 :535-53.
- ↑ Klempner MS, Schmid CH, Hu L, et al. Intralaboratory reliability of serologic and urine testing for Lyme disease. Am J Med 2001;110 :217-9.
- ↑ Dattwyler RJ, Thomas JA, Benach JL, Golightly MG. Cellular immune response in Lyme disease : The response to mitogens, live Borrelia burgdorferi, NK cell function and lymphocyte subsets. Zentralbl Bakteriol Mikrobiol Hyg (A) 1986;263 :151-9.
- ↑ Ostrov BE, Athreya BH. Lyme disease. Difficulties in diagnosis and management. Pediatr Clin North Am 1991; 38 :535-53.
- ↑ J. Waton, A. -L. Pinaulta, J. Pouahaa and F. Truchetet ; Borreliose de Lyme mimant une dermatomyosite (Lyme disease could mimic dermatomyositis) ; La Revue de Médecine Interne Volume 28, Issue 5, May 2007, Pages 343-345 ; DOI :10.1016/j. revmed. 2007.01.002
- ↑ Cette précision figure bien en toutes lettres sur une boîte contenant deux «Tire-Tic», produit, vendu en pharmacie, des laboratoires Clément-Thékan à Montrouge (France).
- ↑ Weber K. 1996 Treatment failure in erythema migrans : a review. Infection, 24 :73-5.
- ↑ Steere AC, Coburn J, Glickstein L. The emergence of Lyme disease. J Clin Invest 2004;113 :1093--101.
- ↑ Wormser GP, Dattwyler RJ, Shapiro ED, et al. The clinical assessment, treatment, and prevention of Lyme disease, human granulocytic anaplasmosis, and babesiosis : clinical practice guidelines by the Infectious Diseases Society of America. Clin Infect Dis 2006;43 :1089--134.
- ↑ Revue d'articles relatifs à des études ayant montré les capacités de résistance des borrélies aux antibiothérapies
- ↑ Meier P; Gau M; Spencker FB; Gau M; Spencker FB; Wiedemann P. GR; Kamradt T ; 1998 Pars plana vitrectomy in Borrelia burgdorferi endophthalmitis ; Klin Monatsbl Augenheilkd, 213 (6) :351-4.
- ↑ Mursic VP; Wanner G; Reinhardt S; Wilske B; Busch U; Marget W. 1996 Formation and cultivation of Borrelia burgdorferi spheroplast L-form variants. Infection, 24 (3) :218-26
- ↑ Luft BJ; Dattwyler RJ; 1996 ; Azithromycin compared with amoxicillin in the treatment of erythema migrans A double-blind, randomized, controlled trial. Annals of Internal Medicine, 124 (9) :785-91
- ↑ Bayer ME; Zhang L; Bayer MH. ; 1996 ; Borrelia burgdorferi DNA in the urine of treated patients with Lyme disease chronic symptoms. A PCR study of 97 cases. ; Infection, 24 No. 5
- ↑ Priem S; Burmester MG ; Krause A. 1998 Detection of Borrelia burgdorferi by polymerase chain reaction in synovial membrane, but not in synovial fluid from patients with persisting Lyme arthritis after antibiotic therapy ; Annals of the Rheumatic Diseases, 57 (2) :118-21
- ↑ Straubinger RK; Straubinger AF; Summers BA; Jacobson RH; Erb HN ; 1998 ; Clinical manifestations, pathogenesis, and effect of antibiotic treatment on Lyme borreliosis in dogs. Wien Klin Wochenschr, 110 (24) :874-81. Conclusion des auteurs : «B. burgdorferi disseminates through tissue by migration following tick inoculation, produces episodes of acute arthritis, and establishes persistent infection. The spirochete survives antibiotic treatment and disease can be reactivated in immunosuppressed animals. »
- ↑ Straubinger RK; Summers BA; Chang YF; Appel MJ. ;1997 Persistence of Borrelia burgdorferi in experimentally infected dogs after antibiotic treatment. Journal of Clinical Microbiology, 35 (1) :111-6
- ↑ Straubinger RK;Straubinger AF ; 1997 ; Two lessons from the canine model of Lyme Disease : migration of Borrelia burgdorferi in tissues and persistence after antibiotic treatment Journal of Spirochetal & Tick-limite Diseases, Vol. 4, N°1/2
- ↑ Stricker RB ; Counterpoint : long-term antibiotic therapy improves persistent symptoms associated with Lyme disease ; Journal Clinical infectious diseases, publication officielle de l'Infectious Diseases Society of America ; vol 45, pages 149 à 157 ; Juillet 2007 ; PMID :17578772; DOI :10.1086/518853
- ↑ Klempner MS, Hu LT, Evans J, et al ; Two controlled trials of antibiotic treatment in patients with persistent symptoms and a history of Lyme disease ; journal N. Engl. J. Med. ; volume=345, issue=2, pages 85–92 ; Juillet 2001 ; pmid=11450676 ; DOI= ; (Voir)
- ↑ Kaplan RF, Trevino RP, Johnson GM, et al ; Cognitive function in post-treatment Lyme disease : do additional antibiotics help ? ; journal=Neurology ; Vol 60, issue=12, pages=1916–22, juin 2003 ; PMID :12821733 (Télécharger)
- ↑ Fallon BA, Keilp JG, Corbera KM, Petkova E, Britton CB, Dwyer E, Slavov I, Cheng J, Dobkin J, Nelson DR, Sackeim HA A randomized, placebo-controlled trial of repeated IV antibiotic therapy for Lyme encephalopathy ; Journal : Neurology |vol 70, issue=13, pages 992–1003 ; Mars 2008 ; PMID :17928580 ; DOI :10.1212/01. WNL. 0000284604.61160.2d Télécharger
- ↑ Medpage
- ↑ Plusieurs groupes d'experts dont l'Infectious Diseases Society of America et l'Académie américaine de Neurologie (American Academy of Neurology) ont trouvé qu'il existait pas de preuves scientifiquement argumentées en faveur d'un traitement antibiotique prolongé contre les Borrelia dans ce type de cas.
- ↑ Feder HM, Johnson BJ, O'Connell S, et al ; A critical appraisal of "chronic Lyme disease" ; Journal N. Engl. J. Med. ; vol 357, 14 ; pages=1422–30 ; Octobre 2007 PLID :17914043 ; DOI :10.1056/NEJMra072023
- ↑ Infectious Diseases Society of America : Questions habituelles à propos de la maladie de Lyme (en Anglais) , Consulté 2008 06 24
- ↑ Piesman J, Eisen L. Prevention of tick-limite diseases. Annu Rev Entomol 2008;53 :323--43.
- ↑ Ginsberg HS, Butler M, Zhioua E. Effect of deer exclusion by fencing on abundance of Amblyomma americanum (Acari : Ixodidæ) on Fire Island, New York, USA. J Vector Ecol 2002;27 :215--21.13, 14)
- ↑ Wormser GP, Dattwyler RJ, Shapiro ED, et al. The clinical assessment, treatment, and prevention of Lyme disease, human granulocytic anaplasmosis, and babesiosis : clinical practice guidelines by the Infectious Diseases Society of America. Clin Infect Dis 2006;43 :1089--134.
- ↑ Parola P, Beati L, Cambon M, Raoult D. First isolation of Rickettsia helvetica from Ixodes ricinus ticks in France. Eur J Clin Microbiol Infect Dis. 1998 Feb; 17 (2) : 95-100 (Résumé)
- ↑ Mazella FM, et al. A case of concurrent presentation of human ehrlichiosis and Lyme disease in Connecticut. Conn Med. 1996 Sep; 60 (9) : 515-9.
- ↑ Krause PJ, Telford IIISR, Spielman A, Sikand V, Ryan R, Christianson D, et al. Concurrent Lyme disease and babesiosis evidence for increased severity and duration of illness. JAMA. 1996 ; 275 : 1657-60.
- ↑ Nowakowski J, Schwartz I, Nadelman RB, Liveris D, Aguero-Rosenfeld M, Wormser GP. Culture-confirmed infection and reinfection with Borrelia burgdorferi. Ann Intern Med. 1997;127 :130-2. PMID :9230002
- ↑ Golde WT, Robinson-Dunn B, Stobierski MG, Dykhuizen D, Wang IN, Carlson V, et al. Culture-confirmed reinfection of a person with different strains of Borrelia burgdorferi sensu stricto. J Clin Microbiol. 1998;36 :1015-9. ; PMID :9542928
Voir aussi
Liens externes
Recherche sur Google Images : |
|
"Sur le même sujet" L'image ci-contre est extraite du site futura-sciences.com Il est possible que cette image soit réduite par rapport à l'originale. Elle est peut-être protégée par des droits d'auteur. Voir l'image en taille réelle (200 x 117 - 9 ko - jpg)Refaire la recherche sur Google Images |
Recherche sur Amazone (livres) : |
Voir la liste des contributeurs.
La version présentée ici à été extraite depuis cette source le 22/11/2009.
Ce texte est disponible sous les termes de la licence de documentation libre GNU (GFDL).
La liste des définitions proposées en tête de page est une sélection parmi les résultats obtenus à l'aide de la commande "define:" de Google.
Cette page fait partie du projet Wikibis.

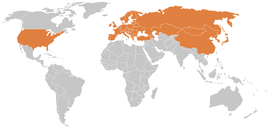
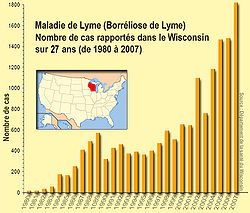
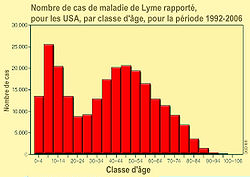
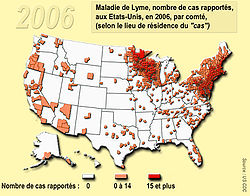
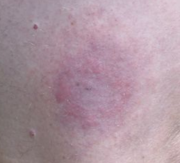
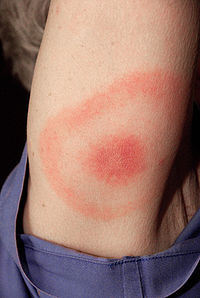

 Accueil
Accueil Recherche
Recherche Début page
Début page Contact
Contact Imprimer
Imprimer Accessibilité
Accessibilité